NIVELACIÓN 1 PERIODO
COREECCION GRUPOS DE LA TABLA PERIÓDICA
INTRODUCCIÓN
En este trabajo se hace una recopilación de los elementos de la tabla periódica ubicados en los grupos
4-5-6-7 en el cual nos ayuda a entender un significado mas grande de cada uno de estos elementos de la tabla periódica también los beneficios y diferentes usos de cada uno de estos elementos; Estos grupos están conformados cada uno por cuatro elementos así que en total serian de dieciséis elementos los que incluye este trabajo.
OBJETIVOS
- Reconocer los elementos que conforman los grupos 4-5-6-7 de la tabla periódica- Comprender el significa de cada uno de estos elementos
- Identificar los diferentes usos que ese le pueden dar a estos elementos
MARCO TEÓRICO
GRUPO 4 DE LA TABLA PERIÓDICA
CARBONO
¿QUE ES?
El carbono es un elemento químico con símbolo C, número atómico 6 y masa atómica 12,01. Es un no metal y tetravalente, disponiendo de cuatro electrones para formar enlaces químicos covalentes. Tres isótopos del carbono se producen de forma natural, los estables 12C y 13C y el isótopo radiactivo 14C, que decae con una vida media de unos 5730 años.1 El carbono es uno de los pocos elementos conocidos desde la antigüedad y es el pilar básico de la química orgánica. Está presente en la Tierra en el estado de cuerpo simple (carbón y diamantes), de compuestos inorgánicos (CO2 y CaCO3) y de compuestos orgánicos (biomasa, petróleo y gas natural). También se han sintetizado muchas nuevas estructuras basadas en el carbono: carbón activado, negro de humo, fibras, nanotubos, fullerenos y grafeno.El carbono es el 15.º elemento más abundante en la corteza terrestre,y el cuarto elemento más abundante en el universo en masa después del hidrógeno, el helio y el oxígeno. La abundancia de carbono, su diversidad única de compuestos orgánicos y su inusual capacidad para formar polímeros a las temperaturas comúnmente encontradas en la Tierra, permite que este elemento sirva como un elemento común de toda la vida conocida. Es el segundo elemento más abundante en el cuerpo humano en masa (aproximadamente el 18,5%) después del oxígeno.4
Los átomos de carbono pueden unirse de diferentes maneras, denominadas alótropos del carbono, reflejo de las condiciones de formación. Los más conocidos que ocurren naturalmente son el grafito, el diamante y el carbono amorfo. Las propiedades físicas del carbono varían ampliamente con la forma alotrópica. Por ejemplo, el grafito es opaco y negro, mientras que el diamante es altamente transparente. El grafito es lo suficientemente blando como para formar una raya en el papel (de ahí su nombre, del verbo griego "γράφειν" que significa 'escribir'), mientras que el diamante es el material natural más duro conocido. El grafito es un buen conductor eléctrico mientras que el diamante tiene una baja conductividad eléctrica. En condiciones normales, el diamante, los nanotubos de carbono y el grafeno tienen las conductividades térmicas más altas de todos los materiales conocidos. Todos los alótropos del carbono son sólidos en condiciones normales, siendo el grafito la forma termodinámicamente estable. Son químicamente resistentes y requieren altas temperaturas para reaccionar incluso con oxígeno.
El estado de oxidación más común del carbono en los compuestos inorgánicos es +4, mientras que +2 se encuentra en el monóxido de carbono y en complejos carbonilos de metales de transición. Las mayores fuentes de carbono inorgánico son las calizas, dolomitas y dióxido de carbono, pero cantidades significativas se producen en depósitos orgánicos de carbón, turba, petróleo y clatratos de metano. El carbono forma un gran número de compuestos, más que cualquier otro elemento, con casi diez millones de compuestos descritos hasta la fecha (con 500.000 compuestos nuevos por año), siendo sin embargo ese número sólo una fracción del número de compuestos teóricamente posibles bajo condiciones estándar. Por esta razón, a menudo el carbono se ha descrito como el «rey de los elementos».
La combustión del carbono en todas sus formas ha sido la base del desarrollo tecnológico desde tiempos prehistóricos. Los materiales basados en el carbono tienen aplicaciones en numerosas áreas de vanguardia tecnológica: materiales compuestos, baterías de iones de litio, descontaminación del aire y del agua, electrodos para hornos de arco, en la síntesis de aluminio, etc.
CARACTERÍSTICAS
El carbono es un elemento notable por varias razones. Sus formas alotrópicas incluyen, una de las sustancias más blandas (el grafito) y una de las más duras (el diamante) y, desde el punto de vista económico, es de los materiales más baratos (carbón) y uno de los más caros (diamante). Más aún, presenta una gran afinidad para enlazarse químicamente con otros átomos pequeños, incluyendo otros átomos de carbono con los que puede formar largas cadenas, y su pequeño radio atómico le permite formar enlaces múltiples.
Así, con el oxígeno forma el dióxido de carbono, vital para el crecimiento de las plantas (ver ciclo del carbono); con el hidrógeno forma numerosos compuestos denominados genéricamente hidrocarburos, esenciales para la industria y el transporte en la forma de combustibles fósiles; y combinado con oxígeno e hidrógeno forma gran variedad de compuestos como, por ejemplo, los ácidos grasos, esenciales para la vida, y los ésteres que dan sabor a las frutas; además es vector, a través del ciclo carbono-nitrógeno, de parte de la energía producida por el Sol.
Así, con el oxígeno forma el dióxido de carbono, vital para el crecimiento de las plantas (ver ciclo del carbono); con el hidrógeno forma numerosos compuestos denominados genéricamente hidrocarburos, esenciales para la industria y el transporte en la forma de combustibles fósiles; y combinado con oxígeno e hidrógeno forma gran variedad de compuestos como, por ejemplo, los ácidos grasos, esenciales para la vida, y los ésteres que dan sabor a las frutas; además es vector, a través del ciclo carbono-nitrógeno, de parte de la energía producida por el Sol.
APLICACIONES O USOS
El principal uso industrial del carbono es como un componente de hidrocarburos, especialmente los combustibles fósiles (petróleo y gas natural). Del primero se obtienen, por destilación en las refinerías, gasolinas, queroseno y aceites, siendo además la materia prima empleada en la obtención de plásticos. El segundo se está imponiendo como fuente de energía por su combustión más limpia.
Otros usos son:
- El isótopo radiactivo carbono-14, descubierto el 27 de febrero de 1940, se usa en la datación radiométrica.
- El grafito se combina con arcilla para fabricar las minas de los lápices. Además se utiliza como aditivo en lubricantes. Las pinturas anti-radar utilizadas en el camuflaje de vehículos y aviones militares están basadas igualmente en el grafito, intercalando otros compuestos químicos entre sus capas. Es negro y blando. Sus átomos están distribuidos en capas paralelas muy separadas entre sí. Se forma a menos presión que el diamante. Aunque parezca difícil de creer, un diamante y la mina de un lapicero tienen la misma composición química: carbono.
- El diamante es transparente y muy duro. En su formación, cada átomo de carbono está unido de forma compacta a otros cuatro átomos. Se originan con temperaturas y presiones altas en el interior de la tierra. Se emplea para la construcción de joyas y como material de corte aprovechando su dureza.
- Como elemento de aleación principal de los aceros.
- En varillas de protección de reactores nucleares.
- Las pastillas de carbón se emplean en medicina para absorber las toxinas del sistema digestivo y como remedio de la flatulencia.
- El carbón activado se emplea en sistemas de filtrado y purificación de agua.
- El carbón amorfo ("hollín") se añade a la goma para mejorar sus propiedades mecánicas. Además se emplea en la formación de electrodos. Obtenido por sublimación del grafito, es fuente de los fullerenos que pueden ser extraídos con disolventes orgánicos.
- Los fullerenos se emplean en medicina, se ha probado que un derivado soluble en agua del C60 inhibe a los virus de inmunodeficiencia humana VIH-1 y VIH-2.10
- La fibra de carbono (obtenido generalmente por termólisis de fibras de poliacrilato) debido a que son de alta resistencia se añade a resinas de poliéster, obteniéndose los materiales denominados fibras de carbono, son empleadas para fabricar raquetas de tenis.
- La fibra de carbono también se utiliza para la elaboración de bicicletas de gama alta, logrando un menor peso, mayor resistencia y mejor geometría.
- Las propiedades químicas y estructurales de los fullerenos, en la forma de nanotubos, prometen usos futuros en el incipiente campo de la nanotecnología.
SILICIO
¿QUE ES?
Símbolo Si, número atómico 14 y peso atómico 28.086. El silicio es el elemento electropositivo más abundante de la corteza terrestre. Es un metaloide con marcado lustre metálico y sumamente quebradizo. Por lo regular, es tetravalente en sus compuestos, aunque algunas veces es divalente, y es netamente electropositivo en su comportamiento químico. Además, se conocen compuestos de silicio pentacoordinados y hexacoordinados.
El silicio elemental crudo y sus compuestos intermetálicos se emplean como integrantes de aleaciones para dar mayor resistencia al aluminio, magnesio, cobre y otros metales. el silicio metalúrgico con pureza del 98-99% se utiliza como materia prima en la manufactura de compuestos organosilícicos y resinas de silicona, elastómeros y aceites. Los chips de silicio se emplean en circuitos integrados. Las células fotovoltaicas para la conversión directa de energía solar en eléctrica utilizan obleas cortadas de cristales simples de silicio de grado electrónico. El dióxido de silicio se emplea como materia prima para producir silicio elemental y carburo de silicio. Los cristales grandes de silicio se utilizan para cristales piezoeléctricos. Las arenas de cuarzo fundido se transforman en vidrios de silicio que se usan en los laboratorios y plantas químicas, así como en aislantes eléctricos. Se emplea una dispersión coloidal de silicio en agua como agente de recubrimiento y como ingrediente de ciertos esmaltes.
El silicio natural contiene 92.2% del isótopo de masa número 28, 4.7% de silicio-29 y 3.1% de silicio-30. Además de estos isótopos naturales estables, se conocen varios isótopos radiactivos artificiales. El silicio elemental tiene las propiedades físicas de los metaloides, parecidas a las del germanio, situado debajo de él en el grupo IV de la tabla periódica. En su forma más pura, el silicio es un semiconductor intrínseco, aunque la intensidad de su semiconducción se ve enormemente incrementada al introducir pequeñas cantidades de impurezas. El silicio se parece a los metales en su comportamiento químico. Es casi tan electropositivo como el estaño y mucho más positivo que el germanio o el plomo. De acuerdo con este carácter más bien metálico, forma iones tetrapositivos y diversos compuestos covalentes; aparece como un ion negativo sólo en unos pocos siliciuros y como un constituyente positivo de oxiácidos o aniones complejos.
Forma varias series de hidruros, diversos halogenuros (algunos de los cuales contienen enlaces silicio-silicio) y muchas series de compuestos que contienen oxígeno, que pueden tener propiedades iónicas o covalentes.
El silicio se encuentra en muchas formas de dióxidos y en innumerables variaciones de los silicatos naturales. Para un análisis de las estructuras y composiciones de las clases representativas.
Por su abundancia, el silicio excede en mucho a cualquier otro elemento, con excepción del oxígeno. Constituye el 27.72% de la corteza sólida de la Tierra, mientras que el oxígeno constituye el 46.6%, y el siguiente elemento después del silicio, el aluminio se encuentra en un 8.13%.
Se sabe que el silicio forma compuestos con 64 de los 96 elementos estables y probablemente forme siliciuros con otros 18 elementos. Además de los siliciuros metálicos, que se utilizan en grandes cantidades en metalurgia, forma compuestos importantes y de empleo frecuente con hidrógeno, carbono, los halógenos, nitrógeno, oxígeno y azufre. Además, se han preparado derivados organosilícicos de gran utilidad.
Se prepara en forma de polvo amarillo pardo o de cristales negros-grisáceos. Se obtiene calentando sílice, o dióxido de silicio (SiO2), con un agente reductor, como carbono o magnesio, en un horno eléctrico. El silicio cristalino tiene una dureza de 7, suficiente para rayar el vidrio, de dureza de 5 a 7. El silicio tiene un punto de fusión de 1.411 °C, un punto de ebullición de 2.355 °C y una densidad relativa de 2,33(g/ml). Su masa atómica es 28,086 u (unidad de masa atómica).
Se disuelve en ácido fluorhídrico formando el gas tetrafluoruro de silicio, SiF4 (ver flúor), y es atacado por los ácidos nítrico, clorhídrico y sulfúrico, aunque el dióxido de silicio formado inhibe la reacción. También se disuelve en hidróxido de sodio, formando silicato de sodio y gas hidrógeno. A temperaturas ordinarias el silicio no es atacado por el aire, pero a temperaturas elevadas reacciona con el oxígeno formando una capa de sílice que impide que continúe la reacción. A altas temperaturas reacciona también con nitrógeno y cloro formando nitruro de silicio y cloruro de silicio, respectivamente.
El silicio constituye un 28 % de la corteza terrestre. No existe en estado libre, sino que se encuentra en forma de dióxido de silicio y de silicatos complejos. Los minerales que contienen silicio constituyen cerca del 40 % de todos los minerales comunes, incluyendo más del 90 % de los minerales que forman rocas volcánicas. El mineral cuarzo, sus variedades (cornalina, crisoprasa, ónice, pedernal y jaspe) y los minerales cristobalita y tridimita son las formas cristalinas del silicio existentes en la naturaleza. El dióxido de silicio es el componente principal de la arena. Los silicatos (en concreto los de aluminio, calcio y magnesio) son los componentes principales de las arcillas, el suelo y las rocas, en forma de feldespatos, anfíboles, piroxenos, micas y zeolitas, y de piedras semipreciosas como el olivino, granate, zircón, topacio y turmalina.
Silicio como base bioquímica
Sus características compartidas con el carbono, como estar en la misma familia 14, no ser metal propiamente dicho, poder construir compuestos parecidos a las enzimas (zeolitas), otros compuestos largos con oxígeno (siliconas) y poseer los mismos cuatro enlaces básicos, le confiere cierta oportunidad en llegar a ser base de seres vivos, aunque no sea en la Tierra, en una bioquímica hipotética.
El silicio elemental crudo y sus compuestos intermetálicos se emplean como integrantes de aleaciones para dar mayor resistencia al aluminio, magnesio, cobre y otros metales. el silicio metalúrgico con pureza del 98-99% se utiliza como materia prima en la manufactura de compuestos organosilícicos y resinas de silicona, elastómeros y aceites. Los chips de silicio se emplean en circuitos integrados. Las células fotovoltaicas para la conversión directa de energía solar en eléctrica utilizan obleas cortadas de cristales simples de silicio de grado electrónico. El dióxido de silicio se emplea como materia prima para producir silicio elemental y carburo de silicio. Los cristales grandes de silicio se utilizan para cristales piezoeléctricos. Las arenas de cuarzo fundido se transforman en vidrios de silicio que se usan en los laboratorios y plantas químicas, así como en aislantes eléctricos. Se emplea una dispersión coloidal de silicio en agua como agente de recubrimiento y como ingrediente de ciertos esmaltes.
El silicio natural contiene 92.2% del isótopo de masa número 28, 4.7% de silicio-29 y 3.1% de silicio-30. Además de estos isótopos naturales estables, se conocen varios isótopos radiactivos artificiales. El silicio elemental tiene las propiedades físicas de los metaloides, parecidas a las del germanio, situado debajo de él en el grupo IV de la tabla periódica. En su forma más pura, el silicio es un semiconductor intrínseco, aunque la intensidad de su semiconducción se ve enormemente incrementada al introducir pequeñas cantidades de impurezas. El silicio se parece a los metales en su comportamiento químico. Es casi tan electropositivo como el estaño y mucho más positivo que el germanio o el plomo. De acuerdo con este carácter más bien metálico, forma iones tetrapositivos y diversos compuestos covalentes; aparece como un ion negativo sólo en unos pocos siliciuros y como un constituyente positivo de oxiácidos o aniones complejos.
Forma varias series de hidruros, diversos halogenuros (algunos de los cuales contienen enlaces silicio-silicio) y muchas series de compuestos que contienen oxígeno, que pueden tener propiedades iónicas o covalentes.
El silicio se encuentra en muchas formas de dióxidos y en innumerables variaciones de los silicatos naturales. Para un análisis de las estructuras y composiciones de las clases representativas.
Por su abundancia, el silicio excede en mucho a cualquier otro elemento, con excepción del oxígeno. Constituye el 27.72% de la corteza sólida de la Tierra, mientras que el oxígeno constituye el 46.6%, y el siguiente elemento después del silicio, el aluminio se encuentra en un 8.13%.
Se sabe que el silicio forma compuestos con 64 de los 96 elementos estables y probablemente forme siliciuros con otros 18 elementos. Además de los siliciuros metálicos, que se utilizan en grandes cantidades en metalurgia, forma compuestos importantes y de empleo frecuente con hidrógeno, carbono, los halógenos, nitrógeno, oxígeno y azufre. Además, se han preparado derivados organosilícicos de gran utilidad.
CARACTERÍSTICAS
Sus propiedades son intermedias entre las del carbono y el germanio. En forma cristalina es muy duro y poco soluble y presenta un brillo metálico y color grisáceo. Aunque es un elemento relativamente inerte y resiste la acción de la mayoría de los ácidos, reacciona con los halógenos y álcalis diluidos. El silicio transmite más del 95 % de las longitudes de onda de la radiación infrarroja.Se prepara en forma de polvo amarillo pardo o de cristales negros-grisáceos. Se obtiene calentando sílice, o dióxido de silicio (SiO2), con un agente reductor, como carbono o magnesio, en un horno eléctrico. El silicio cristalino tiene una dureza de 7, suficiente para rayar el vidrio, de dureza de 5 a 7. El silicio tiene un punto de fusión de 1.411 °C, un punto de ebullición de 2.355 °C y una densidad relativa de 2,33(g/ml). Su masa atómica es 28,086 u (unidad de masa atómica).
Se disuelve en ácido fluorhídrico formando el gas tetrafluoruro de silicio, SiF4 (ver flúor), y es atacado por los ácidos nítrico, clorhídrico y sulfúrico, aunque el dióxido de silicio formado inhibe la reacción. También se disuelve en hidróxido de sodio, formando silicato de sodio y gas hidrógeno. A temperaturas ordinarias el silicio no es atacado por el aire, pero a temperaturas elevadas reacciona con el oxígeno formando una capa de sílice que impide que continúe la reacción. A altas temperaturas reacciona también con nitrógeno y cloro formando nitruro de silicio y cloruro de silicio, respectivamente.
El silicio constituye un 28 % de la corteza terrestre. No existe en estado libre, sino que se encuentra en forma de dióxido de silicio y de silicatos complejos. Los minerales que contienen silicio constituyen cerca del 40 % de todos los minerales comunes, incluyendo más del 90 % de los minerales que forman rocas volcánicas. El mineral cuarzo, sus variedades (cornalina, crisoprasa, ónice, pedernal y jaspe) y los minerales cristobalita y tridimita son las formas cristalinas del silicio existentes en la naturaleza. El dióxido de silicio es el componente principal de la arena. Los silicatos (en concreto los de aluminio, calcio y magnesio) son los componentes principales de las arcillas, el suelo y las rocas, en forma de feldespatos, anfíboles, piroxenos, micas y zeolitas, y de piedras semipreciosas como el olivino, granate, zircón, topacio y turmalina.
Silicio como base bioquímica
Sus características compartidas con el carbono, como estar en la misma familia 14, no ser metal propiamente dicho, poder construir compuestos parecidos a las enzimas (zeolitas), otros compuestos largos con oxígeno (siliconas) y poseer los mismos cuatro enlaces básicos, le confiere cierta oportunidad en llegar a ser base de seres vivos, aunque no sea en la Tierra, en una bioquímica hipotética.
USOS
Se utiliza en aleaciones, en la preparación de las siliconas, en la industria de la cerámica técnica y, debido a que es un material semiconductor muy abundante, tiene un interés especial en la industria electrónica y microelectrónica como material básico para la creación de obleas o chips que se pueden implantar en transistores, pilas solares y una gran variedad de circuitos electrónicos. El silicio es un elemento vital en numerosas industrias. El dióxido de silicio (arena y arcilla) es un importante constituyente del hormigón y los ladrillos, y se emplea en la producción de cemento portland. Por sus propiedades semiconductoras se usa en la fabricación de transistores, células solares y todo tipo de dispositivos semiconductores; por esta razón se conoce como el Valle del Silicio a la región de California en la que concentran numerosas empresas del sector de la electrónica y la informática. También se están estudiando las posibles aplicaciones del siliceno, que es una forma alotrópica del silicio que forma una red bidimensional similar al grafeno. Otros importantes usos del silicio son:
- Como material refractario, se usa en cerámicas, vidriados y esmaltados.
- Como elemento fertilizante en forma de mineral primario rico en silicio, para la agricultura.
- Como elemento de aleación en fundiciones.
- Fabricación de vidrio para ventanas y aislantes.
- El carburo de silicio es uno de los abrasivos más importantes.
- Se usa en láseres para obtener una luz con una longitud de onda de 456 nm.
- La silicona se usa en medicina en implantes de seno y lentes de contacto.
Se utiliza en la industria del acero como componente de las aleaciones de silicio-acero. Para fabricar el acero, se desoxida el acero fundido añadiéndole pequeñas cantidades de silicio; el acero común contiene menos de un 0,30 % de silicio. El acero al silicio, que contiene de 2,5 a 4 % de silicio, se usa para fabricar los núcleos de los transformadores eléctricos, pues la aleación presenta baja histéresis (véase Magnetismo). Existe una aleación de acero, el durirón, que contiene un 15 % de silicio y es dura, frágil y resistente a la corrosión; el durirón se usa en los equipos industriales que están en contacto con productos químicos corrosivos. El silicio se utiliza también en las aleaciones de cobre, como el bronce y el latón.
El silicio es un semiconductor; su resistividad a la corriente eléctrica a temperatura ambiente varía entre la de los metales y la de los aislantes. La conductividad del silicio se puede controlar añadiendo pequeñas cantidades de impurezas llamadas dopantes. La capacidad de controlar las propiedades eléctricas del silicio y su abundancia en la naturaleza han posibilitado el desarrollo y aplicación de los transistores y circuitos integrados que se utilizan en la industria electrónica.
La sílice y los silicatos se utilizan en la fabricación de vidrio, barnices, esmaltes, cemento y porcelana, y tienen importantes aplicaciones individuales. La sílice fundida, que es un vidrio que se obtiene fundiendo cuarzo o hidrolizando tetracloruro de silicio, se caracteriza por un bajo coeficiente de dilatación y una alta resistencia a la mayoría de los productos químicos. El gel de sílice es una sustancia incolora, porosa y amorfa; se prepara eliminando parte del agua de un precipitado gelatinoso de ácido silícico, SiO2•H2O, el cual se obtiene añadiendo ácido clorhídrico a una disolución de silicato de sodio. El gel de sílice absorbe agua y otras sustancias y se usa como agente desecante y decolorante.
El silicato de sodio (Na2SiO3), también llamado vidrio, es un silicato sintético importante, sólido amorfo, incoloro y soluble en agua, que funde a 1088 °C. Se obtiene haciendo reaccionar sílice (arena) y carbonato de sodio a alta temperatura, o calentando arena con hidróxido de sodio concentrado a alta presión. La disolución acuosa de silicato de sodio se utiliza para conservar huevos; como sustituto de la cola o pegamento para hacer cajas y otros contenedores; para unir gemas artificiales; como agente incombustible, y como relleno y adherente en jabones y limpiadores. Otro compuesto de silicio importante es el carborundo, un compuesto de silicio y carbono que se utiliza como abrasivo.
- Como material refractario, se usa en cerámicas, vidriados y esmaltados.
- Como elemento fertilizante en forma de mineral primario rico en silicio, para la agricultura.
- Como elemento de aleación en fundiciones.
- Fabricación de vidrio para ventanas y aislantes.
- El carburo de silicio es uno de los abrasivos más importantes.
- Se usa en láseres para obtener una luz con una longitud de onda de 456 nm.
- La silicona se usa en medicina en implantes de seno y lentes de contacto.
Se utiliza en la industria del acero como componente de las aleaciones de silicio-acero. Para fabricar el acero, se desoxida el acero fundido añadiéndole pequeñas cantidades de silicio; el acero común contiene menos de un 0,30 % de silicio. El acero al silicio, que contiene de 2,5 a 4 % de silicio, se usa para fabricar los núcleos de los transformadores eléctricos, pues la aleación presenta baja histéresis (véase Magnetismo). Existe una aleación de acero, el durirón, que contiene un 15 % de silicio y es dura, frágil y resistente a la corrosión; el durirón se usa en los equipos industriales que están en contacto con productos químicos corrosivos. El silicio se utiliza también en las aleaciones de cobre, como el bronce y el latón.
El silicio es un semiconductor; su resistividad a la corriente eléctrica a temperatura ambiente varía entre la de los metales y la de los aislantes. La conductividad del silicio se puede controlar añadiendo pequeñas cantidades de impurezas llamadas dopantes. La capacidad de controlar las propiedades eléctricas del silicio y su abundancia en la naturaleza han posibilitado el desarrollo y aplicación de los transistores y circuitos integrados que se utilizan en la industria electrónica.
La sílice y los silicatos se utilizan en la fabricación de vidrio, barnices, esmaltes, cemento y porcelana, y tienen importantes aplicaciones individuales. La sílice fundida, que es un vidrio que se obtiene fundiendo cuarzo o hidrolizando tetracloruro de silicio, se caracteriza por un bajo coeficiente de dilatación y una alta resistencia a la mayoría de los productos químicos. El gel de sílice es una sustancia incolora, porosa y amorfa; se prepara eliminando parte del agua de un precipitado gelatinoso de ácido silícico, SiO2•H2O, el cual se obtiene añadiendo ácido clorhídrico a una disolución de silicato de sodio. El gel de sílice absorbe agua y otras sustancias y se usa como agente desecante y decolorante.
El silicato de sodio (Na2SiO3), también llamado vidrio, es un silicato sintético importante, sólido amorfo, incoloro y soluble en agua, que funde a 1088 °C. Se obtiene haciendo reaccionar sílice (arena) y carbonato de sodio a alta temperatura, o calentando arena con hidróxido de sodio concentrado a alta presión. La disolución acuosa de silicato de sodio se utiliza para conservar huevos; como sustituto de la cola o pegamento para hacer cajas y otros contenedores; para unir gemas artificiales; como agente incombustible, y como relleno y adherente en jabones y limpiadores. Otro compuesto de silicio importante es el carborundo, un compuesto de silicio y carbono que se utiliza como abrasivo.
Elemento químico, metálico, gris plata, quebradizo, símbolo Ge, número atómico 32, peso atómico 72.59, punto de fusión 937.4ºC (1719ºF) y punto de ebullición 2830ºC (5130ºF), con propiedades entre el silicio y estaño. El germanio se encuentra muy distribuido en la corteza terrestre con una abundancia de 6.7 partes por millon (ppm). El germanio se halla como sulfuro o está asociado a los sulfuros minerales de otros elementos, en particular con los del cobre, zinc, plomo, estaño y antimonio.
El germanio tiene una apariencia metálica, pero exhibe las propiedades físicas y químicas de un metal sólo en condiciones especiales, dado que está localizado en la tabla periódica en donde ocurre la transición de metales a no metales. A temperatura ambiente hay poca indicación de flujo plástico y, en consecuencia, se comporta como un material quebradizo.
El germanio es divalente o tetravalente. Los compuestos divalentes (óxido, sulfuro y los halogenuros) se oxidan o reducen con facilidad. Los compuestos tetravalentes son más estables. Los compuestos organogermánicos son numerosos y, en este aspecto, el germanio se parece al silicio. El interés en los compuestos organogermánicos se centra en su acción biológica. El germanio y sus derivados parecen tener una toxicidad menor en los mamíferos que los compuestos de estaño o plomo.
Las propiedades del germanio son tales que este elemento tiene varias aplicaciones importantes, especialmente en la industria de los semiconductores. El primer dispositivo de estado sólido, el transistor, fue hecho de germanio. Los cristales especiales de germanio se usan como sustrato para el crecimiento en fase vapor de películas finas de GaAs y GaAsP en algunos diodos emisores de luz. Se emplean lentes y filtros de germanio en aparatos que operan en la región infrarroja del espectro. Mercurio y cobre impregnados de germanio son utilizados en detectores infrarrojos; los granates sintéticos con propiedades magnéticas pueden tener aplicaciones en los dispositivos de microondas para alto poder y memoria de burbuja magnética; los aditivos de germanio incrementa los amper-horas disponibles en acumuladores.
El germanio tiene una apariencia metálica, pero exhibe las propiedades físicas y químicas de un metal sólo en condiciones especiales, dado que está localizado en la tabla periódica en donde ocurre la transición de metales a no metales. A temperatura ambiente hay poca indicación de flujo plástico y, en consecuencia, se comporta como un material quebradizo.
El germanio es divalente o tetravalente. Los compuestos divalentes (óxido, sulfuro y los halogenuros) se oxidan o reducen con facilidad. Los compuestos tetravalentes son más estables. Los compuestos organogermánicos son numerosos y, en este aspecto, el germanio se parece al silicio. El interés en los compuestos organogermánicos se centra en su acción biológica. El germanio y sus derivados parecen tener una toxicidad menor en los mamíferos que los compuestos de estaño o plomo.
Las propiedades del germanio son tales que este elemento tiene varias aplicaciones importantes, especialmente en la industria de los semiconductores. El primer dispositivo de estado sólido, el transistor, fue hecho de germanio. Los cristales especiales de germanio se usan como sustrato para el crecimiento en fase vapor de películas finas de GaAs y GaAsP en algunos diodos emisores de luz. Se emplean lentes y filtros de germanio en aparatos que operan en la región infrarroja del espectro. Mercurio y cobre impregnados de germanio son utilizados en detectores infrarrojos; los granates sintéticos con propiedades magnéticas pueden tener aplicaciones en los dispositivos de microondas para alto poder y memoria de burbuja magnética; los aditivos de germanio incrementa los amper-horas disponibles en acumuladores.
CARACTERÍSTICAS
Es un semimetal, de color blanco grisáceo lustroso, quebradizo, que conserva el brillo a temperaturas ordinarias. Presenta la misma estructura cristalina que el diamante y resiste a los ácidos y álcalis.
Forma gran número de compuestos organometálicos y es un importante material semiconductor utilizado en transistores y fotodetectores. A diferencia de la mayoría de semiconductores, el germanio tiene una pequeña banda prohibida (band gap) por lo que responde de forma eficaz a la radiación infrarroja y puede usarse en amplificadores de baja intensidad.
El término proviene del latín Germania, mismo nombre que se le daba a las tierras germanas. Fue predicho por el legendario químico ruso Dmítri Ivánovich Mendeléyev, quien cuando creó la primer tabla periódica de los elementos químicos, nombró a este metal como eka-silicio, en el año 1871. En 1886, el químico alemán Clemens Winkler logró demostrar la existencia de este elemento y la eficacia de la teoría de la periodicidad de Mendeléyev, siéndole atribuido así el descubrimiento del germanio.
En su estado puro, el germanio es un metaloide sólido y duro, cristalino y quebradizo, y de un color blanco con tonalidades grisáceas que incluso a temperatura ambiente mantiene un brillo muy particular. Como semiconductor, el germanio presenta propiedades excelentes y se conocen cinco isótopos naturales de este elemento: 70 Ge, 72 Ge, 73 Ge, 74 Ge y 76 Ge.
En la naturaleza, el germanio puede hallarse en determinados minerales, siendo abundante en varias regiones norteamericanas y también en Europa, especialmente en Rusia. Dos minerales de germanio importantes son la argirodita; un sulfuro de germanio y plata, y la llamada germanita, un mineral que contiene hasta un 8 % de nuestro elemento.
Otras formas de obtener germanio refieren a procesos artificiales del Hombre, como por ejemplo el procesamientos de minerales de zinc, donde se lo puede aislar del polvo de los hornos de fundición. Hoy en día, numerosas técnicas de refinamiento se han desarrollado para la producción de germanio cristalino, que tiene mínimas impurezas y se emplea con suma frecuencia en el sector industrial y sobre todo la electrónica.
el estaño tiene su origen etimológico en las lenguas anglosajonas, pero se deriva del latín stannum y el antiguo stāgnum, término que significa “sustancia”. Se sabe que los humanos tienen conocimiento de esta sustancia desde tiempos remotos y se estima que el Hombre comenzó a utilizar el estaño en los comienzos de la Edad del Bronce, es decir, por el año 3000 a.C., aproximádamente.
El estaño es el elemento número 50 de la tabla periódica, ubicándose en el grupo 14. Es un metal plateado con tonalidades blanquecinas, es muy dúctil y también es maleable, siendo uno de los metales de post-transición más suaves que existen, aunque también de los menos efectivos en cuanto a conductividad. El estaño tiene 9 isótopos estables y se conocen otros 18 que no lo son. Respecto a su estructura, también es altamente cristalina y curiosamente, cuando se dobla, produce un sonido muy pero muy peculiar: el llamado “grito de estaño”, que también lo presenta el indio (elemento número 49 de la tabla).
En la naturaleza, el estaño se encuentra principalmente en el mineral de la casiterita. La mayor producción de este elemento proviene de Malasia, Bolivia, Indonesia, Tailandia y Nigeria, obteniéndose mediante la reducción de mena con carbón.
También se usa para disminuir la fragilidad del vidrio.
Los compuestos de estaño se usan para fungicidas, tintes, dentífricos y pigmentos.
Se usa para realizar bronce, aleación de estaño y cobre.
Se usa para la soldadura blanda, aleado con plomo.
Se usa en aleación con plomo para fabricar la lámina de los tubos de los órganos musicales.
Tiene utilidad en etiquetas.
Recubrimiento de acero.
Se usa como material de aporte en soldadura blanda con cautín, bien puro o aleado. La directiva RoHS prohíbe el uso de plomo en la soldadura de determinados aparatos eléctricos y electrónicos.
El estaño también se utiliza en la industria de la cerámica para la fabricación de los esmaltes cerámicos. Su función es la siguiente: en baja y en alta es un opacificante. En alta la proporción del porcentaje es más alto que en baja temperatura.
Es usado también en el sobretaponado de botellas de vino, en forma de cápsula. Su uso se extendió tras la prohibición del uso del plomo en la industria alimentaria. España es uno de los mayores fabricantes de cápsulas de estaño.
Forma gran número de compuestos organometálicos y es un importante material semiconductor utilizado en transistores y fotodetectores. A diferencia de la mayoría de semiconductores, el germanio tiene una pequeña banda prohibida (band gap) por lo que responde de forma eficaz a la radiación infrarroja y puede usarse en amplificadores de baja intensidad.
El término proviene del latín Germania, mismo nombre que se le daba a las tierras germanas. Fue predicho por el legendario químico ruso Dmítri Ivánovich Mendeléyev, quien cuando creó la primer tabla periódica de los elementos químicos, nombró a este metal como eka-silicio, en el año 1871. En 1886, el químico alemán Clemens Winkler logró demostrar la existencia de este elemento y la eficacia de la teoría de la periodicidad de Mendeléyev, siéndole atribuido así el descubrimiento del germanio.
En su estado puro, el germanio es un metaloide sólido y duro, cristalino y quebradizo, y de un color blanco con tonalidades grisáceas que incluso a temperatura ambiente mantiene un brillo muy particular. Como semiconductor, el germanio presenta propiedades excelentes y se conocen cinco isótopos naturales de este elemento: 70 Ge, 72 Ge, 73 Ge, 74 Ge y 76 Ge.
En la naturaleza, el germanio puede hallarse en determinados minerales, siendo abundante en varias regiones norteamericanas y también en Europa, especialmente en Rusia. Dos minerales de germanio importantes son la argirodita; un sulfuro de germanio y plata, y la llamada germanita, un mineral que contiene hasta un 8 % de nuestro elemento.
Otras formas de obtener germanio refieren a procesos artificiales del Hombre, como por ejemplo el procesamientos de minerales de zinc, donde se lo puede aislar del polvo de los hornos de fundición. Hoy en día, numerosas técnicas de refinamiento se han desarrollado para la producción de germanio cristalino, que tiene mínimas impurezas y se emplea con suma frecuencia en el sector industrial y sobre todo la electrónica.
USOS
Las aplicaciones del germanio se ven limitadas por su elevado costo y en muchos casos se investiga su sustitución por materiales más económicos.
- Fibra óptica.
- Electrónica: radares y amplificadores de guitarras eléctricas usados para recrear sonidos de la primera época del rock and roll; aleaciones de Germanato de Silicio (SiGe) en circuitos integrados de alta velocidad. También se utilizan compuestos sandwich Si/Ge para aumentar la movilidad de los electrones en el silicio (streched silicon).
- Óptica de infrarrojos: Espectroscopios, sistemas de visión nocturna y otros equipos.
- Lentes, con alto índice de refracción, de ángulo ancho y para microscopios.
- En joyería se usa la aleación Au con 12% de germanio.
- Como elemento endurecedor del aluminio, magnesio y estaño.
- Quimioterapia.
- El tetracloruro de germanio es un ácido de Lewis y se usa como catalizador en la síntesis de polímeros (PET).
ESTAÑO
¿QUE ES?
Elemento químico, de símbolo Sn, número atómico 50 y peso atómico 118.69. Forma compuesto de estaño(II) o estañoso(Sn2+) y estaño(IV) o estánico (Sn4+), así como sales complejas del tipo estanito (M2SnX4) y estanato (M2SnX6).
Se funde a baja temperatura; tiene gran fluidez cuando se funde y posee un punto de ebullición alto. es suave, flexible y resistente a la corrosión en muchos medios. Una aplicación importante es el recubrimiento de envases de acero para conservar alimentos y bebidas. Otros empleos importantes son: aleaciones para soldar, bronces, pletres y aleaciones industriales diversas. Los productos químicos de estaño, tanto inorgánicos como orgánicos, se utilizan mucho en las industrias de galvanoplastia, cerámica y plásticos, y en la agricultura.
El mineral del estaño más importante es la casiterita, SnO2. No se conocen depósitos de alta calidad de este mineral. La mayor parte del mineral de estaño del mundo se obtiene de depósitos aluviales de baja calidad.
Existen dos formas alotrópicas del estaño: estaño blanco y estaño gris. Es estño reacciona tanto con ácidos fuertes como con bases fuertes, pero es relativamente resistente a soluciones casi neutras. En muy diversas circunstancias corrosiva, no se desprende el gas hidrógeno del estaño y la velocidad de corrosión está controlada por el suministro de oxígeno u otros agentes oxidantes; en su ausencia, la corrosión es despreciable. Se forma una película delgada de óxido estánico sobre el estaño que está expuesto al aire y esto origina una protección superficial. Las sales que tienen una reacción ácida en solución, como el cloruro de aluminio y el cloruro férrico, atacan el estaño en presencia de oxidantes o aire. La mayor parte de los líquidos no acuosos, como los aceite, los alcoholes o los hidrocarburos clorinados, no tienen efectos obvios sobre el estaño o son muy pequeños. El estaño y las sales inorgánicas simples no son tóxicos, pero sí lo son algunas formas de compuesto organoestañosos.
El óxido estanoso, SnO es un producto cristalino de color negro-azul, soluble en los ácidos comunes y en bases fuertes. Se emplea para fabricar sales estanosas en galvanoplastia y en manufactura de vidrio. El óxido estánico, SnO2, es un polvo blanco, insoluble en ácidos y álcalis. Es un excelente opacador de brillo y componente de colorantes cerámicos rosas, amarillos y marrones y de cuerpos refractarios y dieléctricos. Es un importante agente pulidor del mármol y de las piedras decorativas.
El cloruro estanoso, SnCl2, es el ingrediente principal en el galvanoestañado ácido con electrólitos e intermediario de algunos compuesto químicos de estaño. El cloruro estánico, SnCl4, en la forma pentahidratada es un sólido blanco. Se utiliza en la preparación de compuestos organoestañosos y químicos para añadir peso a la seda y para estabilizar perfumes y colores en jabones. El fluoruro estañoso, SnF2, compuesto blanco soluble en agua, es un aditivo de las pastas dentales.
Los compuestos organoestañosos son aquellos en que existe al menos un enlace estaño-carbono; el estaño suele presentar un estado de oxidación de +IV. Los compuestos organoestañosos que encuentran aplicación en la industria son los que tienen la fórmula R4Sn, R3SnX, R2SnX2 y RSnX3. R es un grupo orgánico, como metilo, butilo, octilo, o fenilo, mientras que X es un sustituyente inorgánico, por lo regular cloruro, fluoruro, óxido, hidróxido, carboxilatos o tioles.
CARACTERISTICAS
Es un metal blanco, maleable, que se oxida fácilmente, a temperatura ambiente, cambiando de color a un gris más opaco, y es resistente a la corrosión. Se encuentra en muchas aleaciones y se usa para recubrir otros metales protegiéndolos de la corrosión. Al doblar una barra de este metal se produce un sonido característico llamado grito del estaño, producido por la fricción de los cristales que la componen. Una de sus características más llamativas es que bajo determinadas condiciones térmicas sufre la peste del estaño. El estaño puro tiene dos variantes alotrópicas: el estaño gris, polvo no metálico, semiconductor, de estructura cúbica y estable a temperaturas inferiores a 13,2 °C, que es muy frágil y tiene un peso específico más bajo que el blanco; y el estaño blanco, el normal, metálico, conductor eléctrico, de estructura tetragonal y estable a temperaturas por encima de 13,2 °C.el estaño tiene su origen etimológico en las lenguas anglosajonas, pero se deriva del latín stannum y el antiguo stāgnum, término que significa “sustancia”. Se sabe que los humanos tienen conocimiento de esta sustancia desde tiempos remotos y se estima que el Hombre comenzó a utilizar el estaño en los comienzos de la Edad del Bronce, es decir, por el año 3000 a.C., aproximádamente.
El estaño es el elemento número 50 de la tabla periódica, ubicándose en el grupo 14. Es un metal plateado con tonalidades blanquecinas, es muy dúctil y también es maleable, siendo uno de los metales de post-transición más suaves que existen, aunque también de los menos efectivos en cuanto a conductividad. El estaño tiene 9 isótopos estables y se conocen otros 18 que no lo son. Respecto a su estructura, también es altamente cristalina y curiosamente, cuando se dobla, produce un sonido muy pero muy peculiar: el llamado “grito de estaño”, que también lo presenta el indio (elemento número 49 de la tabla).
En la naturaleza, el estaño se encuentra principalmente en el mineral de la casiterita. La mayor producción de este elemento proviene de Malasia, Bolivia, Indonesia, Tailandia y Nigeria, obteniéndose mediante la reducción de mena con carbón.
USOS
Se usa como protector del hierro, del acero y de diversos metales usados en la fabricación de latas de conserva.También se usa para disminuir la fragilidad del vidrio.
Los compuestos de estaño se usan para fungicidas, tintes, dentífricos y pigmentos.
Se usa para realizar bronce, aleación de estaño y cobre.
Se usa para la soldadura blanda, aleado con plomo.
Se usa en aleación con plomo para fabricar la lámina de los tubos de los órganos musicales.
Tiene utilidad en etiquetas.
Recubrimiento de acero.
Se usa como material de aporte en soldadura blanda con cautín, bien puro o aleado. La directiva RoHS prohíbe el uso de plomo en la soldadura de determinados aparatos eléctricos y electrónicos.
El estaño también se utiliza en la industria de la cerámica para la fabricación de los esmaltes cerámicos. Su función es la siguiente: en baja y en alta es un opacificante. En alta la proporción del porcentaje es más alto que en baja temperatura.
Es usado también en el sobretaponado de botellas de vino, en forma de cápsula. Su uso se extendió tras la prohibición del uso del plomo en la industria alimentaria. España es uno de los mayores fabricantes de cápsulas de estaño.
PLOMO
¿QUE ES?
Elemento químico, Pb, número atómico 82 y peso atómico 207.19. El plomo es un metal pesado (densidad relativa, o gravedad específica, de 11.4 s 16ºC (61ºF)), de color azuloso, que se empaña para adquirir un color gris mate. Es flexible, inelástico, se funde con facilidad, se funde a 327.4ºC (621.3ºF) y hierve a 1725ºC (3164ºF). Las valencias químicas normales son 2 y 4. Es relativamente resistente al ataque de los ácidos sulfúrico y clorhídrico. Pero se disuelve con lentitud en ácido nítrico. El plomo es anfótero, ya que forma sales de plomo de los ácidos, así como sales metálicas del ácido plúmbico. El plomo forma muchas sales, óxidos y compuestos organometálicos.
Industrialmente, sus compuestos más importantes son los óxidos de plomo y el tetraetilo de plomo. El plomo forma aleaciones con muchos metales y, en general, se emplea en esta forma en la mayor parte de sus aplicaciones. Todas las aleaciones formadas con estaño, cobre, arsénico, antimonio, bismuto, cadmio y sodio tienen importancia industrial.
Los compuestos del plomo son tóxicos y han producido envenenamiento de trabajadores por su uso inadecuado y por una exposición excesiva a los mismos. Sin embargo, en la actualidad el envenenamiento por plomo es raro en virtud e la aplicación industrial de controles modernos, tanto de higiene como relacionados con la ingeniería. El mayor peligro proviene de la inhalación de vapor o de polvo. En el caso de los compuestos organoplúmbicos, la absorción a través de la piel puede llegar a ser significativa. Algunos de los síntomas de envenenamiento por plomo son dolores de cabeza, vértigo e insomnio. En los casos agudos, por lo común se presenta estupor, el cual progresa hasta el coma y termina en la muerte. El control médico de los empleados que se encuentren relacionados con el uso de plomo comprende pruebas clínicas de los niveles de este elemento en la sangre y en la orina. Con un control de este tipo y la aplicación apropiada de control de ingeniería, el envenenamiento industrial causado por el plomo puede evitarse por completo.
El plomo rara vez se encuentra en su estado elemental, el mineral más común es el sulfuro, la galeana, los otros minerales de importancia comercial son el carbonato, cerusita, y el sulfato, anglesita, que son mucho más raros. También se encuentra plomo en varios minerales de uranio y de torio, ya que proviene directamente de la desintegración radiactiva (decaimiento radiactivo). Los minerales comerciales pueden contener tan poco plomo como el 3%, pero lo más común es un contenido de poco más o menos el 10%. Los minerales se concentran hasta alcanzar un contenido de plomo de 40% o más antes de fundirse.
CARACTERISTICAS
El plomo en la naturaleza nunca se halla en su estado puro, sino formando sales metálicas, óxidos y compuestos organometálicos.
La mayoría de los minerales de los que se extrae contienen un porcentaje entre 3 y 10% de plomo.
Por eso, para obtenerlo deben ser triturados y concentrados hasta alcanzar al menos el 70%.
Es común que se halle contaminado de plata, oro y bismuto, e incluso otros elementos como antimonio, zinc y azufre. Estas sustancias pueden ser retiradas durante las etapas de horneado para preparar el metal.
Los compuestos de plomo más utilizados en la industria son los óxidos de plomo, el tetraetilo de plomo y los silicatos de plomo. El plomo forma aleaciones con muchos metales, y, en general, se emplea en esta forma en la mayor parte de sus aplicaciones. Es un metal pesado y tóxico, y la intoxicación por plomo se denomina como saturnismo o plumbosis.
El plomo está constituido por muchos isótopos, siendo estables cuatro de ellos: 204Pb, 206Pb, 207Pb, y 208Pb.
Al 204Pb se le conoce como plomo primordial, y el 206Pb, 207Pb y 208Pb se forman por la desintegración radioactiva de dos isótopos del uranio (235U y 238U) y un isótopo del torio (232Th).
El 210Pb es radioactivo y un precursor del 210Po en la serie de decaimiento del 238U.
La concentración de 210Pb en fumadores es el doble que la concentración en no fumadores. Esta diferencia se atribuye a la inhalación de 210Pb en el humo del tabaco.
USOS
Su utilización como cubierta para cables, ya sea la de teléfono, de televisión, de internet o de electricidad, sigue siendo una forma de empleo adecuada. La ductilidad única del plomo lo hace muy apropiado para esta aplicación, porque puede estirarse para formar un forro continuo alrededor de los conductos internos.
El uso del plomo en pigmentos sintéticos o artificiales ha sido muy importante, pero está decreciendo en volumen. Los pigmentos que se utilizan con más frecuencia e intervienen en este elemento son:
El blanco de plomo (conocido también como albayalde) 2PbCO3.Pb(OH)2
Sulfato básico de plomo
El tetróxido de plomo también conocido como minio.
Cromatos de plomo.
El silicatoeno de plomo (más conocido en la industria de los aceros blandos)
Se utilizan una gran variedad de compuestos de plomo, como los silicatos, los carbonatos y sales de ácidos orgánicos, como estabilizadores contra el calor y la luz para los plásticos de cloruro de polivinilo. Se usan silicatos de plomo para la fabricación de frituras (esmaltes) de vidrio y de cerámica, las que resultan útiles para introducir plomo en los acabados del vidrio y de la cerámica. La azida de plomo, Pb(N3)2, es el detonador estándar para los explosivos plásticos como el C-4 u otros tipos de explosivos H.E. (High Explosive). Los arseniatos de plomo se emplean en grandes cantidades como insecticidas para la protección de los cultivos y para ahuyentar insectos molestos como cucarachas, mosquitos y otros animales que posean un exoesqueleto. El litargirio (óxido de plomo) se emplea mucho para mejorar las propiedades magnéticas de los imanes de cerámica de ferrita de bario.
Asimismo, una mezcla calcinada de zirconato de plomo y de titanato de plomo, conocida como PETE, está ampliando su mercado como un material piezoeléctrico.
GRUPO 5 DE LA TABLA PERIÓDICA
NITRÓGENO
lemento químico, símbolo N, número atómico 7, peso atómico 14.0067; es un gas en condiciones normales. El nitrógeno molecular es el principal constituyente de la atmósfera ( 78% por volumen de aire seco). Esta concentración es resultado del balance entre la fijación del nitrógeno atmosférico por acción bacteriana, eléctrica (relámpagos) y química (industrial) y su liberación a través de la descomposición de materias orgánicas por bacterias o por combustión. En estado combinado, el nitrógeno se presenta en diversas formas. Es constituyente de todas las proteínas (vegetales y animales), así como también de muchos materiales orgánicos. Su principal fuente mineral es el nitrato de sodio.
Gran parte del interés industrial en el nitrógeno se debe a la importancia de los compuestos nitrogenados en la agricultura y en la industria química; de ahí la importancia de los procesos para convertirlo en otros compuestos. El nitrógeno también se usa para llenar los bulbos de las lámparas incandescentes y cuando se requiere una atmósfera relativamente inerte.
El nitrógeno, consta de dos isótopos, 14N y 15N, en abundancia relativa de 99.635 a 0.365. Además se conocen los isótopos radiactivos 12N, 13N, 16N y 17N, producidos por una variedad de reacciones nucleares. A presión y temperatura normales, el nitrógeno molecular es un gas con una densidad de 1.25046 g por litro.
El nitrógeno elemental tiene una reactividad baja hacia la mayor parte de las sustancias comunes, a temperaturas ordinarias. A altas temperaturas, reacciona con cromo, silicio, titanio, aluminio, boro, berilio, magnesio, bario, estroncio, calcio y litio para formar nitruros; con O2, para formar NO, y en presencia de un catalizador, con hidrógeno a temperaturas y presión bastante altas, para formar amoniaco. El nitrógeno, carbono e hidrógeno se combinan arriba de los 1800ºC (3270ºF) para formar cianuro de hidrógeno.
Cuando el nitrógeno molecular se somete a la acción de un electrodo de descarga condensada o a una descarga de alta frecuencia se activa en forma parcial a un intermediario inestable y regresa al estado basal con emisión de un resplandor amarillo oro.
Los elementos de la familia del nitrógeno exhiben tres estados de oxidación principales, -3, +3 y +5 en sus compuestos, aunque también se presentan otros estados de oxidación. Todos los elementos de la familia del nitrógeno forman hidruros, así como óxidos +3, óxidos +5, haluros +3 (MX3) y, excepto para el nitrógeno y el bimuto, halogenuros +5 (MX5). E1 nitrógeno es el elemento más electronegativo de la familia. Así, además de los estados de oxidación típicos de la familia (-3,+3 y +5), el nitrógeno forma compuestos con otros estados de oxidación.
Los compuestos que contienen una molécula de nitrógeno enlazada a un metal se llaman complejos de nitrógeno o complejos dinitrógeno. Los metales que pertenecen al grupo VIII de la familia de los metales de transición son extraordinarios en su capacidad para formar compuestos de coordinación; para cada metal de este grupo se han identificado varios complejos nitrogenados. Los complejos nitrogenados de estos metales se presentan en estados de oxidación bajos, como Co(I) o Ni(O), los otros ligandos presentes en estos complejos, además de N2, son del tipo que se sabe que estabilizan estados de oxidación bajos: las fofinas parecen ser particularmente útiles a este respecto.
No obstante y sin alejarnos del hecho del descubrimiento, cabe mencionar que otros científicos, tales como Cavendish, Priestley o Scheele (quien logró aislarlo), también fueron sumamente importantes en el desarrollo y la comprensión del nitrógeno. Por último, cabe mencionar que, de cierto modo, los alquimistas y otros hombre de ciencia, ya tenían cierta noción acerca de este elemento en la Edad Media, utilizándolo en forma de ácido nítrico, el cual llamaban “aqua fortis”.
Comúnmente, en condiciones naturales, el nitrógeno es un gas diatómico y compone casi que el 80% (78,1%) del aire que todos respiramos. Se trata de un no metal gaseoso, es inodoro, insípido e incoloro, generalmente siendo considerado un elemento inerte. A nuestro alrededor podemos encontrar nitrógeno en todas partes y compuestos de nitrógeno pueden hallarse desde en alimentos a fertilizantes, venenos e incluso explosivos. Además, este gas es el responsable de los colores rojo, naranja, azul, verde y violeta que se forma en los cielos, por ejemplo al amanecer o en las auroras.
Al ser un componente básico en todas las proteínas, el nitrógeno es esencial para la vida y es un compuesto biológico primordial para la vida. El gas nitrógeno puede obtenerse mediante licuefacción, así como por destilación fraccionada, pero en nuestra atmósfera existe un suministro verdaderamente inagotable.
El ciclo natural del nitrógeno es uno de los ciclos naturales más importantes del planeta, absolutamente necesarios para la vida. Si bien el gas nitrógeno es inerte, en el suelo, las bacterias realizan un complejo proceso que produce el nitrógeno necesario para que las plantas crezcan. Luego los animales comen las plantas en las que el nitrógeno se ha introducido, incorporándolo a su sistema y el ciclo se completa cuando las bacterias convierten los desechos de nitrógeno en gas.
El antimonio difiere de los metales normales por tener una conductividad eléctrica menor en estado sólido que en estado líquido (como su compañero de grupo el bismuto). El antimonio metálico es muy quebradizo, de color blanco-azuloso con un brillo metálico característico, de apariencia escamosa. Aunque a temperaturas normales es estable al aire, cuando se calienta se quema en forma luminosa desprendiendo humos blancos de Sb2O3. La vaporización del metal forma moléculas de Sb4O6, que se descomponen en Sb2O3 por arriba de la temperatura de transición.
El antimonio se encuentra principalmente en la naturaleza como Sb2S3 (estibnita, antimonita); el Sb2O3 (valentinita) se halla como producto de descomposición de la estibnita. Forma parte por lo general de los minerales de cobre, plata y plomo. También se encuentran en la naturaleza los antimoniuros metálicos NiSb (breithaupita), NiSbS (ulmanita) y Ag2Sb (dicrasita); existen numerosos tioantimoniatos como el Ag3SbS3 (pirargirita).
El antimonio se obtiene calentando el sulfuro con hierro, o calentando el sulfuro y el sublimado de Sb4O6 obtenido se reduce con carbono; el antimonio de alta pureza se produce por refinado electrolítico.
El antimonio de grado comercial se utiliza en muchas aleaciones (1-20%), en especial de plomo, las cuales son más duras y resistentes mecánicamente que el plomo puro; casi la mitad de todo el antimonio producido se consume en acumuladores, revestimiento de cables, cojinetes antifricción y diversas clases de metales de consumo. La propiedad que tienen las aleaciones de Sn-Sb-Pb de dilatarse al enfriar el fundido permiten la producción de vaciados finos, que hacen útil este tipo de metal.
Las estimaciones sobre la abundancia de antimonio en la corteza terrestre van desde 0,2 a 0,5 ppm. El antimonio es calcófilo, presentándose con azufre y con otros elementos como plomo, cobre y plata.
El origen etimológico del antimonio proviene de los términos griegos anti y monos, que significa algo así como “el que no se encuentra solo”, pero la nominalización de su símbolo atómico (Sb) proviene del latín stibium, que significa “banco de arena gris brillante”. Se estima que el antimonio comenzó a utilizarse ampliamente en el siglo XVII; no obstante, se cree que en realidad se tiene conocimiento de este elemento desde la antigüedad.
Ahora bien, el antimonio es un metal plateado de un característico color gris brillante que pertenece al grupo de los metaloides en la tabla periódica de los elementos. Se trata de un elemento muy malo para la conducción del calor y también la electricidad, además, hay muchas formas compuestas de este metal que son considerablemente tóxicas.
Si bien es un metal poco abundante y rar vez se lo ha encontrado en estado natural, mínimas cantidades se de antimonio se pueden encontrar en unos 100 tipos de minerales diferentes, siendo el sulfuro de estibina su fuente principal. En su forma elemental, el antimonio se caracteriza por una estructura sólida y cristalina que se puede fundir y también quebrar con gran facilidad.
Desde que la batería eléctrica de plomo y ácido fue desarrollada en el siglo XIX, ha sido en gran medida la batería secundaria (o recargable) más importante por todo el mundo. Se utilizan en vehículos de motor, o como baterías industriales.
Las baterías eléctricas industriales incluyen las baterías de acumuladores de tracción en las locomotoras de las minas, carros del golf, y así sucesivamente, baterías de "energía de emergencia". El antimonio en aleación con el plomo es usado para ciertas piezas de los acumuladores eléctricos para las cuales la resistencia a la corrosión es necesaria.
El antimonio es un componente menor pero importante de muchas soldaduras suaves, que son las soldaduras que funden en temperaturas debajo del 625 K. Estas soldaduras pueden contener entre 0,5 y 3% de antimonio. La función del antimonio en estas soldaduras es consolidar la soldadura y suprimir la formación del alótropos de estaño a bajas temperatura, lo que degradaría de otra manera la integridad estructural de los empalmes soldados en las temperaturas debajo del punto de la transición de fase (289 K). El antimonio se ha utilizado como un endurecedor para el plomo usado en la munición.
En los Estados Unidos su uso se confina en gran parte a la fabricación de balas y perdigones. La contaminación del agua subterránea, del suelo y de la cadena trófica con el tóxico plomo ha preocupado por muchos años, y las regulaciones ambientales han conducido al reemplazo del plomo al antimonio con una aleación de tungsteno.
Las aleaciones de plomo que contienen cerca del 2 al 8% de antimonio son resistentes al uso atmosférico y la corrosión por lo que son utilizadas en la construcción de canales y barreras de la humedad. En la industria química, las aleaciones que contienen a partir 4 a 15 % de antimonio proporcionan la protección contra varios estados líquidos de los productos químicos, especialmente del ácido sulfúrico o del azufre. Aleado con bismuto, plomo y estaño, el antimonio es un componente de algunas de las aleaciones fusibles usadas en dispositivos de seguridad de fuego. El metal que se emplea para la fabricación de caracteres y demás material tipográfico se obtiene con una aleación de plomo, antimonio y estaño. El plomo se usa por la fácil fusión y para que la aleación sea dúctil y compacta. El antimonio sirve para dar más resistencia al metal con el fin de que no se aplaste tan fácilmente durante las repetidas y numerosas tiradas. Las aleaciones son diversas, según los tamaños de los tipos y el uso a que se destinan.
Así que para la fabricación del metal destinado a blancos, se suele usar la aleación siguiente, denominada ordinaria: 75 partes de plomo, 20 partes de antimonio y 5 partes de estaño. Cantidades pequeñas de antimonio de gran pureza se utilizan en los vídeo discos (DVD).
Usos no metálicos:
La punta de los fósforos de seguridad contiene trisulfuro de antimonio. La combustión es una reacción exotérmica mantenida por los radicales libres internamente generados y el calor radiante. Los retardadores con halógeno de la llama actúan interfiriendo con el mecanismo de cadena radical en la fase de gas (la llama). Cuando son utilizados por sí mismos, los retardadores de la llama del halógeno se deben utilizar en cantidades muy grandes. Este problema se evita agregando el trióxido del antimonio, que trabaja de forma conjunta con los halógenos, reduciendo la cantidad necesaria de retardante de llama y reduciendo también el coste del tratamiento total. El mecanismo del trabajo conjunto del antimonio y los halógenos se ha intentado explicar de varias maneras, pero ninguna es definitiva.
Muchos plásticos comunes son susceptibles a la degradación por el calor y la luz ultravioleta (UV) y se deben proteger durante la vida de servicio los productos hechos de ellos por la adición de compuestos conocidos como estabilizadores. El antimonio ha sido utilizado desde los años 1950 como estabilizador de calor eficaces para el PVC, especialmente en las formas rígidas del plástico.
El trióxido de antimonio se utiliza como catalizador en la polimerización del PET, que es un plástico usado en las botellas, películas, acondicionamiento de los alimentos, y muchos otros productos. Los compuestos del antimonio, junto con el dióxido de germanio, son los catalizadores preferidos para PET.
El dióxido de germanio da un producto con una transparencia mejor que el antimonio, pero que es demasiado costoso para muchas aplicaciones del PET. El trióxido de antimonio es utilizado también como pigmento blanco para las pinturas exteriores, donde su resistencia al desgaste por la acción atmosférica le hizo el objeto de valor, sin embargo, al descubrirse su capacidad tóxica el trióxido de antimonio ha sido suplantado por el dióxido de titanio (TiO2).
Todavía se utiliza en cantidades significativas como estabilizador del color, donde es importante mantener intensidad del color y evitar el cambio de la tonalidad, por ejemplo en las pinturas amarillas usadas para los autobuses de las escuelas (estadounidenses y sudafricanas) y en las rayas amarillas aplicadas a los pavimentos del camino.
Los pigmentos conductores de la electricidad del óxido de estaño (SnO) con antimonio se han introducido en años recientes para incorporarlos en las capas plásticas que protegen las computadoras y otros componentes electrónicos contra la electricidad estática.
El antimonio fue utilizado en medicina, por su buenas cualidades expectorantes, eméticas y purgantes. Y se llegaron a escribir tratados sobre sus cualidades médicas. Hasta que se decidió declararlo veneno, de forma oficial, el 3 de agosto de 1866. En forma de sales de antimonio Sb(OH)2Cl (Sbv) o como antimonio pentavalente, aún se menciona como tratamiento inicial contra leishmaniasis.
Industria
La mayor parte del O2 producido con propósito comercial se utiliza para la fundición del Hierro en acero.
La fundición de mena de hierro en acero consume el 55 % del oxígeno producido comercialmente.40 En este proceso, el O2 es inyectado mediante una lanza de alta presión en el molde de hierro, que expulsa las impurezas de Azufre y el exceso de Carbono, en forma de sus respectivos óxidos, SO2 y CO2. Las reacciones son exotérmicas y la temperatura asciende hasta los 1700 Cº.40
Otro 25 % de este oxígeno se dedica a la industria química.40 El etileno reacciona con el O2 para crear óxido de etileno, que, a su vez, se convierte en etilenglicol, el material usado como base para fabricar una gran variedad de productos, entre otros los anticongelantes y los polímeros de poliéster (los precursores de muchos plásticos y textiles).
El oxígeno se usa en el oxicorte quemando acetileno con O2 para producir una llama muy caliente. En este proceso, el metal de hasta 60 centímetros de grosor se calienta primero con una pequeña llama de oxiacetileno para después ser rápidamente cortado por un gran chorro de O2.
Ciencia
Los paleoclimatólogos miden la relación entre el oxígeno-18 y el oxígeno-16 en los esqueletos y exoesqueletos de los organismos marinos para determinar cómo era el clima hace millones de años. Las moléculas de agua de mar que contienen el isótopo más ligero, el oxígeno-16, se evaporan a un ritmo ligeramente mayor que las moléculas que contienen oxígeno-18 (un 12 % más pesado); esta disparidad se incrementa a bajas temperaturas. En periodos con una temperatura global más baja, la nieve y la lluvia procedentes de esa agua evaporada tienden a ser más ricas en oxígeno-16, mientras que el agua marina que queda tiende a serlo en oxígeno-18. Los organismos marinos, por tanto, incorporan más oxígeno-18 en sus esqueletos y exoesqueletos de lo que harían en un medio más cálido.Los paleoclimatólogos también miden directamente esta relación en las moléculas de agua de muestras de núcleo de hielo que se han coservado durante varios cientos de miles de años.
Los geólogos planetarios han medido las diferencias en la abundancia de isótopos de oxígeno en muestras de la Tierra, la Luna, Marte y meteoritos, pero no han estado lejos de poder obtener valores de referencia para las relaciones entre isótopos del Sol, que se creen iguales a aquellas de la nebulosa protosolar. Sin embargo, el análisis de una oblea de Silicio expuesta al viento solar en el espacio y devuelta a la Tierra por la sonda Génesis desveló que el Sol tiene una proporción de oxígeno-16 mayor que nuestro planeta. La medición implica que un proceso desconocido agotó el oxígeno-16 del disco protoplanetario del Sol antes de la fusión de los granos de polvo que formaron la Tierra.
En forma de selenio rojo o como seleniuro de sodio el elemento se usa para dar un color rojo escarlata al vidrio, barnices y esmaltes.
Se usa también en gran medida como un decolorante del vidrio porque neutraliza el matiz verdoso producido por los compuestos ferrosos.
Pequeñas cantidades de selenio se agregan al caucho vulcanizado para aumentar su resistencia al desgaste.
El seleniato de sodio es un insecticida usado para combatir insectos en los cultivos de plantas ornamentales, particularmente crisantemos y claveles; los insecticidas se esparcen alrededor de las raíces y es distribuido por la planta.
El sulfuro de selenio se usa en el tratamiento de la caspa, el acné, dermatitis seborreica y otras enfermedades de piel.
El selenio también se usa en fotocopiadoras, semiconductores, aleaciones y células solares.
Se usa también en algunas técnicas fotográficas especiales.
Gran parte del interés industrial en el nitrógeno se debe a la importancia de los compuestos nitrogenados en la agricultura y en la industria química; de ahí la importancia de los procesos para convertirlo en otros compuestos. El nitrógeno también se usa para llenar los bulbos de las lámparas incandescentes y cuando se requiere una atmósfera relativamente inerte.
El nitrógeno, consta de dos isótopos, 14N y 15N, en abundancia relativa de 99.635 a 0.365. Además se conocen los isótopos radiactivos 12N, 13N, 16N y 17N, producidos por una variedad de reacciones nucleares. A presión y temperatura normales, el nitrógeno molecular es un gas con una densidad de 1.25046 g por litro.
El nitrógeno elemental tiene una reactividad baja hacia la mayor parte de las sustancias comunes, a temperaturas ordinarias. A altas temperaturas, reacciona con cromo, silicio, titanio, aluminio, boro, berilio, magnesio, bario, estroncio, calcio y litio para formar nitruros; con O2, para formar NO, y en presencia de un catalizador, con hidrógeno a temperaturas y presión bastante altas, para formar amoniaco. El nitrógeno, carbono e hidrógeno se combinan arriba de los 1800ºC (3270ºF) para formar cianuro de hidrógeno.
Cuando el nitrógeno molecular se somete a la acción de un electrodo de descarga condensada o a una descarga de alta frecuencia se activa en forma parcial a un intermediario inestable y regresa al estado basal con emisión de un resplandor amarillo oro.
Los elementos de la familia del nitrógeno exhiben tres estados de oxidación principales, -3, +3 y +5 en sus compuestos, aunque también se presentan otros estados de oxidación. Todos los elementos de la familia del nitrógeno forman hidruros, así como óxidos +3, óxidos +5, haluros +3 (MX3) y, excepto para el nitrógeno y el bimuto, halogenuros +5 (MX5). E1 nitrógeno es el elemento más electronegativo de la familia. Así, además de los estados de oxidación típicos de la familia (-3,+3 y +5), el nitrógeno forma compuestos con otros estados de oxidación.
Los compuestos que contienen una molécula de nitrógeno enlazada a un metal se llaman complejos de nitrógeno o complejos dinitrógeno. Los metales que pertenecen al grupo VIII de la familia de los metales de transición son extraordinarios en su capacidad para formar compuestos de coordinación; para cada metal de este grupo se han identificado varios complejos nitrogenados. Los complejos nitrogenados de estos metales se presentan en estados de oxidación bajos, como Co(I) o Ni(O), los otros ligandos presentes en estos complejos, además de N2, son del tipo que se sabe que estabilizan estados de oxidación bajos: las fofinas parecen ser particularmente útiles a este respecto.
CARACTERISTICAS
Este nombre se lo adjudicó el médico, químico y botánico escocés Daniel Rutherford, quien descubrió la existencia de este elemento en el año 1772. Para este descubrimiento, Rutherford experimentó quitando el oxígeno y el dióxido de carbono del aire, demostrando así que el gas residual era inútil para la combustión e inútil para los seres vivos.No obstante y sin alejarnos del hecho del descubrimiento, cabe mencionar que otros científicos, tales como Cavendish, Priestley o Scheele (quien logró aislarlo), también fueron sumamente importantes en el desarrollo y la comprensión del nitrógeno. Por último, cabe mencionar que, de cierto modo, los alquimistas y otros hombre de ciencia, ya tenían cierta noción acerca de este elemento en la Edad Media, utilizándolo en forma de ácido nítrico, el cual llamaban “aqua fortis”.
Comúnmente, en condiciones naturales, el nitrógeno es un gas diatómico y compone casi que el 80% (78,1%) del aire que todos respiramos. Se trata de un no metal gaseoso, es inodoro, insípido e incoloro, generalmente siendo considerado un elemento inerte. A nuestro alrededor podemos encontrar nitrógeno en todas partes y compuestos de nitrógeno pueden hallarse desde en alimentos a fertilizantes, venenos e incluso explosivos. Además, este gas es el responsable de los colores rojo, naranja, azul, verde y violeta que se forma en los cielos, por ejemplo al amanecer o en las auroras.
Al ser un componente básico en todas las proteínas, el nitrógeno es esencial para la vida y es un compuesto biológico primordial para la vida. El gas nitrógeno puede obtenerse mediante licuefacción, así como por destilación fraccionada, pero en nuestra atmósfera existe un suministro verdaderamente inagotable.
El ciclo natural del nitrógeno es uno de los ciclos naturales más importantes del planeta, absolutamente necesarios para la vida. Si bien el gas nitrógeno es inerte, en el suelo, las bacterias realizan un complejo proceso que produce el nitrógeno necesario para que las plantas crezcan. Luego los animales comen las plantas en las que el nitrógeno se ha introducido, incorporándolo a su sistema y el ciclo se completa cuando las bacterias convierten los desechos de nitrógeno en gas.
USOS
La aplicación comercial más importante del nitrógeno diatómico es la obtención de amoníaco por el proceso de Haber. El amoníaco se emplea con posterioridad en la fabricación de fertilizantes y ácido nítrico.
Las sales del ácido nítrico incluyen importantes compuestos como el nitrato de potasio (nitro o salitre empleado en la fabricación de pólvora) y el nitrato de amonio fertilizante.
Los compuestos orgánicos de nitrógeno como la nitroglicerina y el trinitrotolueno son a menudo explosivos. La hidracina y sus derivados se usan como combustible en cohetes.
El ciclo de este elemento es bastante más complejo que el del carbono, dado que está presente en la atmósfera no solo como N2 (78 %) sino también en una gran diversidad de compuestos. Se puede encontrar principalmente como N2O, NO y NO2, los llamados NOx. También forma otras combinaciones con oxígeno tales como N2O3 y N2O5 (anhídridos), "precursores" de los ácidos nitroso y nítrico. Con hidrógeno forma amoníaco (NH3), compuesto gaseoso en condiciones normales.
Al ser un gas poco reactivo, el nitrógeno se emplea industrialmente para crear atmósferas protectoras y como gas criogénico para obtener temperaturas del orden de 78K de forma sencilla y económica. Inclusive se utiliza para inflar los neumáticos en los trenes de aterrizaje de los aviones, evitando condensación de agua a grandes alturas o su combustión al aterrizar.
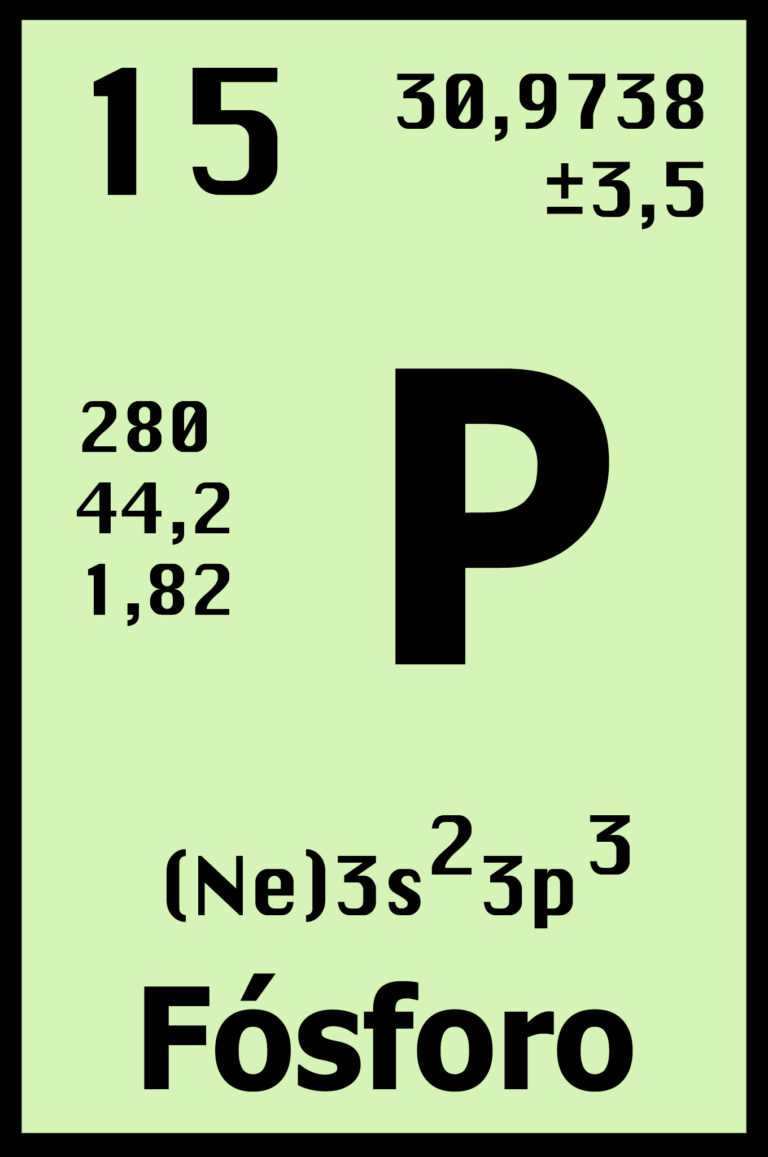
FÓSFORO
¿QUE ES?
Símbolo P, número atómico 15, peso atómico 30.9738. El fósforo forma la base de gran número de compuestos, de los cuales los más importantes son los fosfatos. En todas las formas de vida, los fosfatos desempeñan un papel esencial en los procesos de transferencia de energía, como el metabolismo, la fotosíntesis, la función nerviosa y la acción muscular. Los ácidos nucleicos, que entre otras cosas forman el material hereditario (los cromosomas), son fosfatos, así como cierto número de coenzimas. Los esqueletos de los animales están formados por fosfato de calcio.
Cerca de tres cuartas partes del fósforo total (en todas sus formas químicas) se emplean en Estados Unidos como fertilizantes. Otras aplicaciones importantes son como relleno de detergentes, nutrientes suplementarios en alimentos para animales, ablandadores de agua, aditivos para alimentos y fármacos, agentes de revestimiento en el tratamiento de superficies metálicas, aditivos en metalurgia, plastificantes, insecticidas y aditivos de productos petroleros.
De casi 200 fosfatos minerales diferentes, sólo uno, la fluoropatita, Ca5F(PO4)3, se extrae esencialmente de grandes depósitos secundarios originados en los huesos de animales y que se hallan en el fondo de mares prehistóricos, y de los guanos depositados sobre rocas antiguas.
La investigación de la química del fósforo indica que pueden existir tantos compuestos basados en el fósforo como los de carbono. En química orgánica se acostumbra agrupar varios compuestos químicos dentro de familias llamadas series homólogas.
Esto también puede hacerse en la química de los compuestos de fósforo, aunque muchas familias están incompletas. La familia mejor conocida de estos compuestos es el grupo de cadenas de fosfatos. Las sales de fosfatos constan de cationes, como el sodio, junto con cadenas de aniones, como (PnO3n+1)(n+2)-, que pueden tener de 1 a 1 000 000 de átomos de fósforo por anión.
Los fosfatos se basan en átomos de fósforo rodeados en una disposición tetraédrica por átomos de oxígeno, el miembro más pequeño de la familia es el anión simple PO3-4 (el ion ortofosfato). La familia de las cadenas de fosfato se basa en hileras alternadas de átomos de fósforo y oxígeno en que cada átomo de fósforo permanece en el centro de un tetraedro de cuatro átomos de oxígeno. Hay también una familia estrechamente relacionada de fosfatos cíclicos.
Una característica estructural interesante de muchos de los compuestos del fósforo conocidos es la formación de estructuras tipo jaula. Ejemplos de estas moléculas son el fósforo blanco, P4, y uno de los pentóxidos de fósforo, P4O10. Las estructuras tipo red son comunes; por ejemplo, los cristales de fósforo negro en que los átomos están enlazados unos con otros.
En la mayor parte de sus compuestos, el fósforo está enlazado químicamente a cuatro átomos inmediatos. Hay gran número de compuestos en los que uno de los cuatro átomos está ausente y en su lugar hay un par de electrones no compartidos.
Hay también unos cuantos compuestos con cinco o seis átomos unidos al fósforo; son muy reactivos y tienden a ser inestables. Durante los años 60 y 70, se prepararon muchos compuestos orgánicos de fósforo. La mayor parte de estas estructuras químicas incluye tres o cuatro átomos enlazados al fósforo, pero existen también estructuras con dos, cinco o seis átomos unidos a cada átomo de fósforo.
Casi todo el fósforo utilizado en el comercio está en forma de fosfatos. La mayor parte de los fertilizantes fosfatados constan de ortofosfato diácido de calcio u otofosfato ácido de calcio muy impuros, Ca(H2PO4)2 y CaHPO4. Estos fosfatos son sales del ácido ortofosfórico.
CARACTERISTICAS
El fósforo es un componente esencial de los organismos.
Es el segundo mineral más abundante en el cuerpo humano.
Forma parte de los ácidos nucleicos (ADN y ARN).
Forma parte de los huesos y dientes de los animales.
En las plantas en una porción de 0,2 % y en los animales hasta el 1 % de su masa es fósforo.
El fósforo común es un sólido.
De color blanco, pero puro es incoloro.
Un característico olor desagradable.
Es un no metal.
Emite luz por fosforescencia.
Existen varias formas alotrópicas del fósforo, siendo las más comunes el fósforo blanco y el rojo; ambos forman estructuras tetraédricas de cuatro átomos. El fósforo blanco, extremadamente tóxico e inflamable presenta dos formas, alfa y beta, con una temperatura de transición de −3,8 °C; expuesto a la luz solar o al calor (300 °C) se transforma en fósforo rojo en reacción exotérmica. Éste es más estable y menos volátil y tóxico que el blanco y es el que se encuentra normalmente en los laboratorios y con el que se fabrican las cerillas. El fósforo negro presenta una estructura similar al grafito y conduce la electricidad, es el más denso que los otros dos estados y no se inflama.
Los compuestos del fósforo intervienen en funciones vitales para los seres vivos, por lo que está considerado como un elemento químico esencial, aunque recientes experimentos apuntan que algunas formas de vida pudieran sustituirlo por arsénico. Forma parte de la molécula de Pi («fosfato inorgánico»), así como de las moléculas de ADN y ARN y de los fosfolípidos en las membranas lipídicas. Las células lo utilizan para almacenar y transportar la energía mediante el adenosín trifosfato. Además, la adición y eliminación de grupos fosfato a las proteínas, fosforilación y desfosforilación, respectivamente, es el mecanismo principal para regular la actividad de proteínas intracelulares, y de ese modo el metabolismo de las células eucariotas tales como los espermatozoides.
Los compuestos fosforados se usan también para aclarar las soluciones de azúcar de remolacha y en aleaciones especiales como bronces al fósforo.
El fósforo blanco se usa en la elaboración de veneno para las ratas, insecticidas y en la industria pirotécnica y el fósforo rojo se usa para fabricar cerillas.
En los fósforos ordinarios la cabeza se compone de una mezcla combustible de azufre y clorato de potasio bañada en sulfuro de fósforo que se inflama por el calor producido en la fricción y produce a su vez la inflamación de la mezcla combustible.
En los fósforos de seguridad la cabeza se compone de sulfuro de antimonio mezclado con dicromato de potasio que actúa como oxidante. El rascador de la caja se compone de fósforo rojo y vidrio pulverizado. El calor de la fricción transforma un poco de fósforo rojo en blanco, que se inflama y hace que se prenda la cabeza.
Existen tres alótropos o modificaciones polimórficas del arsénico. La forma a cúbica de color amarillo se obtiene por condensación del vapor a muy bajas temperaturas. La b polimórfica negra, que es isoestructural con el fósforo negro. Ambas revierten a la forma más estable, la l , gris o metálica, del arsénico romboédrico, al calentarlas o por exposición a la luz. La forma metálica es un conductor térmico y eléctrico moderado, quebradizo, fácil de romper y de baja ductibilidad.
Al arsénico se le encuentra natural como mineral de cobalto, aunque por lo general está en la superficie de las rocas combinado con azufre o metales como Mn, Fe, Co, Ni, Ag o Sn. El principal mineral del arsénico es el FeAsS (arsenopirita, pilo); otros arseniuros metálicos son los minerales FeAs2 (löllingita), NiAs (nicolita), CoAsS (cobalto brillante), NiAsS (gersdorfita) y CoAs2 (esmaltita). Los arseniatos y tioarseniatos naturales son comunes y la mayor parte de los minerales de sulfuro contienen arsénico. La As4S4 (realgarita) y As4S6 (oropimente) son los minerales más importantes que contienen azufre. El óxido, arsenolita, As4O6, se encuentra como producto de la alteración debida a los agentes atmosféricos de otros minerales de arsénico, y también se recupera de los polvos colectados de los conductos durante la extracción de Ni, Cu y Sn; igualmente se obtiene al calcinar los arseniuros de Fe, Co o Ni con aire u óxigeno. El elemento puede obtenerse por calcinación de FeAsS o FeAs2 en ausencia de aire o por reducción de As4O6 con carbonato, cuando se sublima As4.
El arsénico elemental tiene pocos usos. Es uno de los pocos minerales disponibles con un 99.9999+ % de pureza. En el estado sólido se ha empleado ampliamente en los materiales láser GaAs y como agente acelerador en la manufactura de varios aparatos. El óxido de arsénico se utiliza en la elaboración de vidrio. Los sulfuros de arsénico se usan como pigmentos y en juegos pirotécnicos. El arseniato de hidrógeno se emplea en medicina, así como otros compuestos de arsénico. La mayor parte de la aplicación medicinal de los compuestos de arsénico se basa en su naturaleza tóxica.
En desuso:
Históricamente el arsénico se ha empleado con fines terapéuticos prácticamente abandonados por la medicina occidental aunque recientemente se ha renovado el interés por su uso como demuestra el caso del trióxido de arsénico para el tratamiento de pacientes con leucemia promielocítica aguda.
Como elemento fertilizante en forma de mineral primario rico, para la agricultura.
A lo largo de la historia el arsénico y sus compuestos han sido utilizados con fines homicidas, fundamentalmente en forma de anhídrido arsenioso (polvo blanco, insípido e inodoro llamado rey de los venenos).
Elaboración de insecticidas, herbicidas, raticidas, fungicidas, etc, aunque cada vez se utiliza menos con estos fines.
Elemento químico con símbolo Sb y número atómico 51. El antimonio no es un elemento abundante en la naturaleza; raras veces se encuentra en forma natural, a menudo como una mezcla isomorfa con arsénico: la allemonita. Su símbolo Sb se deriva de la palabra latina stibium. El antimonio se presenta en dos formas: amarilla y gris. La forma amarilla es metaestable, y se compone de moléculas Sb4, se le encuentra en el vapor de antimonio y es la unidad estructural del antimonio amarillo; la forma gris es metálica, la cual cristaliza en capas formando una estructura romboédrica.Es el segundo mineral más abundante en el cuerpo humano.
Forma parte de los ácidos nucleicos (ADN y ARN).
Forma parte de los huesos y dientes de los animales.
En las plantas en una porción de 0,2 % y en los animales hasta el 1 % de su masa es fósforo.
El fósforo común es un sólido.
De color blanco, pero puro es incoloro.
Un característico olor desagradable.
Es un no metal.
Emite luz por fosforescencia.
Existen varias formas alotrópicas del fósforo, siendo las más comunes el fósforo blanco y el rojo; ambos forman estructuras tetraédricas de cuatro átomos. El fósforo blanco, extremadamente tóxico e inflamable presenta dos formas, alfa y beta, con una temperatura de transición de −3,8 °C; expuesto a la luz solar o al calor (300 °C) se transforma en fósforo rojo en reacción exotérmica. Éste es más estable y menos volátil y tóxico que el blanco y es el que se encuentra normalmente en los laboratorios y con el que se fabrican las cerillas. El fósforo negro presenta una estructura similar al grafito y conduce la electricidad, es el más denso que los otros dos estados y no se inflama.
Los compuestos del fósforo intervienen en funciones vitales para los seres vivos, por lo que está considerado como un elemento químico esencial, aunque recientes experimentos apuntan que algunas formas de vida pudieran sustituirlo por arsénico. Forma parte de la molécula de Pi («fosfato inorgánico»), así como de las moléculas de ADN y ARN y de los fosfolípidos en las membranas lipídicas. Las células lo utilizan para almacenar y transportar la energía mediante el adenosín trifosfato. Además, la adición y eliminación de grupos fosfato a las proteínas, fosforilación y desfosforilación, respectivamente, es el mecanismo principal para regular la actividad de proteínas intracelulares, y de ese modo el metabolismo de las células eucariotas tales como los espermatozoides.
USOS
Los compuestos comerciales más importantes de fósforo son el ácido fosfórico y sus sales, llamadas fosfatos. La mayoría de los compuestos fosforados se usan como fertilizantes.Los compuestos fosforados se usan también para aclarar las soluciones de azúcar de remolacha y en aleaciones especiales como bronces al fósforo.
El fósforo blanco se usa en la elaboración de veneno para las ratas, insecticidas y en la industria pirotécnica y el fósforo rojo se usa para fabricar cerillas.
En los fósforos ordinarios la cabeza se compone de una mezcla combustible de azufre y clorato de potasio bañada en sulfuro de fósforo que se inflama por el calor producido en la fricción y produce a su vez la inflamación de la mezcla combustible.
En los fósforos de seguridad la cabeza se compone de sulfuro de antimonio mezclado con dicromato de potasio que actúa como oxidante. El rascador de la caja se compone de fósforo rojo y vidrio pulverizado. El calor de la fricción transforma un poco de fósforo rojo en blanco, que se inflama y hace que se prenda la cabeza.
ARSÉNICO
¿QUE ES?
Elemento químico, cuyo símbolo es As y su número atómico, 33. El arsénico se encuentra distribuido ampliamente en la naturaleza (cerca de 5 x 10-4% de la corteza terrestre). Es uno de los 22 elementos conocidos que se componen de un solo nucleido estable, 7533As; el peso atómico es de 74.922. Se conocen otros 17 nucleidos radiactivos de As.Existen tres alótropos o modificaciones polimórficas del arsénico. La forma a cúbica de color amarillo se obtiene por condensación del vapor a muy bajas temperaturas. La b polimórfica negra, que es isoestructural con el fósforo negro. Ambas revierten a la forma más estable, la l , gris o metálica, del arsénico romboédrico, al calentarlas o por exposición a la luz. La forma metálica es un conductor térmico y eléctrico moderado, quebradizo, fácil de romper y de baja ductibilidad.
Al arsénico se le encuentra natural como mineral de cobalto, aunque por lo general está en la superficie de las rocas combinado con azufre o metales como Mn, Fe, Co, Ni, Ag o Sn. El principal mineral del arsénico es el FeAsS (arsenopirita, pilo); otros arseniuros metálicos son los minerales FeAs2 (löllingita), NiAs (nicolita), CoAsS (cobalto brillante), NiAsS (gersdorfita) y CoAs2 (esmaltita). Los arseniatos y tioarseniatos naturales son comunes y la mayor parte de los minerales de sulfuro contienen arsénico. La As4S4 (realgarita) y As4S6 (oropimente) son los minerales más importantes que contienen azufre. El óxido, arsenolita, As4O6, se encuentra como producto de la alteración debida a los agentes atmosféricos de otros minerales de arsénico, y también se recupera de los polvos colectados de los conductos durante la extracción de Ni, Cu y Sn; igualmente se obtiene al calcinar los arseniuros de Fe, Co o Ni con aire u óxigeno. El elemento puede obtenerse por calcinación de FeAsS o FeAs2 en ausencia de aire o por reducción de As4O6 con carbonato, cuando se sublima As4.
El arsénico elemental tiene pocos usos. Es uno de los pocos minerales disponibles con un 99.9999+ % de pureza. En el estado sólido se ha empleado ampliamente en los materiales láser GaAs y como agente acelerador en la manufactura de varios aparatos. El óxido de arsénico se utiliza en la elaboración de vidrio. Los sulfuros de arsénico se usan como pigmentos y en juegos pirotécnicos. El arseniato de hidrógeno se emplea en medicina, así como otros compuestos de arsénico. La mayor parte de la aplicación medicinal de los compuestos de arsénico se basa en su naturaleza tóxica.
CARACTERISTICAS
El arsénico se presenta en tres estados alotrópicos, gris o metálico, amarillo y negro.4 El arsénico gris metálico (forma α) es la forma estable en condiciones normales y tiene estructura romboédrica, es un buen conductor del calor pero pobre conductor eléctrico, su densidad es de 5,73 g/cm³, es deleznable y pierde el lustre metálico expuesto al aire.
El arsénico “amarillo” (forma γ) se obtiene cuando el vapor de arsénico se enfría rápidamente. Es extremadamente volátil y más reactivo que el arsénico metálico y presenta fosforescencia a temperatura ambiente. El gas está constituido por moléculas tetraédricas de As4 de forma análoga al fósforo y el sólido formado por la condensación del gas tiene estructura cúbica, es de textura jabonosa y tiene una densidad aproximada de 1,97 g/cm³.6 Expuesto a la luz o al calor revierte a la forma estable (gris). También se denomina arsénico amarillo al oropimente, mineral de trisulfuro de arsénico.
Una tercera forma alotrópica, el arsénico “negro” (forma β) de estructura hexagonal y densidad 4,7 g/cm³, tiene propiedades intermedias entre las formas alotrópicas descritas y se obtiene en la descomposición térmica de la arsina o bien enfriando lentamente el vapor de arsénico.
Todas las formas alotrópicas excepto la gris carecen de lustre metálico y tienen muy baja conductividad eléctrica por lo que el elemento se comportará como metal o no metal en función, básicamente, de su estado de agregación.7 También vea metal pesado.
A presión atmosférica el arsénico sublima a 613 °C, y a 400 °C arde con llama blanca formando el sesquióxido As4O6. Reacciona violentamente con el cloro y se combina, al calentarse, con la mayoría de los metales para formar el arseniuro correspondiente y con el azufre. No reacciona con el ácido clorhídrico en ausencia de oxígeno, pero sí con el nítrico caliente, sea diluido o concentrado y otros oxidantes como el peróxido de hidrógeno, ácido perclórico, etc. Es insoluble en agua pero muchos de sus compuestos lo son.
Es un elemento químico esencial para la vida aunque tanto el arsénico como sus compuestos son extremadamente venenosos.
Se encuentra en el 2.º grupo analítico de cationes; precipita con H2S de color amarillo.
El arsénico “amarillo” (forma γ) se obtiene cuando el vapor de arsénico se enfría rápidamente. Es extremadamente volátil y más reactivo que el arsénico metálico y presenta fosforescencia a temperatura ambiente. El gas está constituido por moléculas tetraédricas de As4 de forma análoga al fósforo y el sólido formado por la condensación del gas tiene estructura cúbica, es de textura jabonosa y tiene una densidad aproximada de 1,97 g/cm³.6 Expuesto a la luz o al calor revierte a la forma estable (gris). También se denomina arsénico amarillo al oropimente, mineral de trisulfuro de arsénico.
Una tercera forma alotrópica, el arsénico “negro” (forma β) de estructura hexagonal y densidad 4,7 g/cm³, tiene propiedades intermedias entre las formas alotrópicas descritas y se obtiene en la descomposición térmica de la arsina o bien enfriando lentamente el vapor de arsénico.
Todas las formas alotrópicas excepto la gris carecen de lustre metálico y tienen muy baja conductividad eléctrica por lo que el elemento se comportará como metal o no metal en función, básicamente, de su estado de agregación.7 También vea metal pesado.
A presión atmosférica el arsénico sublima a 613 °C, y a 400 °C arde con llama blanca formando el sesquióxido As4O6. Reacciona violentamente con el cloro y se combina, al calentarse, con la mayoría de los metales para formar el arseniuro correspondiente y con el azufre. No reacciona con el ácido clorhídrico en ausencia de oxígeno, pero sí con el nítrico caliente, sea diluido o concentrado y otros oxidantes como el peróxido de hidrógeno, ácido perclórico, etc. Es insoluble en agua pero muchos de sus compuestos lo son.
Es un elemento químico esencial para la vida aunque tanto el arsénico como sus compuestos son extremadamente venenosos.
Se encuentra en el 2.º grupo analítico de cationes; precipita con H2S de color amarillo.
USOS
En uso:
Preservante de la madera (arseniato de plomo y cromo), uso que representa, según algunas estimaciones, cerca del 70 % del consumo mundial de arsénico.
El arseniuro de galio es un importante material semiconductor empleado en circuitos integrados más rápidos, y caros, que los de silicio. También se usa en la construcción de diodos láser y LED.
Aditivo en aleaciones de plomo y latones.
Insecticida (arseniato de plomo), herbicidas (arsenito de sodio) y venenos: a principios del siglo XX se usaban compuestos inorgánicos pero su uso ha desaparecido prácticamente en beneficio de compuestos orgánicos (derivados metílicos). Sin embargo, esas aplicaciones están declinando.
El disulfuro de arsénico se usa como pigmento y en pirotecnia.
Decolorante en la fabricación del vidrio (trióxido de arsénico).
Preservante de la madera (arseniato de plomo y cromo), uso que representa, según algunas estimaciones, cerca del 70 % del consumo mundial de arsénico.
El arseniuro de galio es un importante material semiconductor empleado en circuitos integrados más rápidos, y caros, que los de silicio. También se usa en la construcción de diodos láser y LED.
Aditivo en aleaciones de plomo y latones.
Insecticida (arseniato de plomo), herbicidas (arsenito de sodio) y venenos: a principios del siglo XX se usaban compuestos inorgánicos pero su uso ha desaparecido prácticamente en beneficio de compuestos orgánicos (derivados metílicos). Sin embargo, esas aplicaciones están declinando.
El disulfuro de arsénico se usa como pigmento y en pirotecnia.
Decolorante en la fabricación del vidrio (trióxido de arsénico).
En desuso:
Históricamente el arsénico se ha empleado con fines terapéuticos prácticamente abandonados por la medicina occidental aunque recientemente se ha renovado el interés por su uso como demuestra el caso del trióxido de arsénico para el tratamiento de pacientes con leucemia promielocítica aguda.
Como elemento fertilizante en forma de mineral primario rico, para la agricultura.
A lo largo de la historia el arsénico y sus compuestos han sido utilizados con fines homicidas, fundamentalmente en forma de anhídrido arsenioso (polvo blanco, insípido e inodoro llamado rey de los venenos).
Elaboración de insecticidas, herbicidas, raticidas, fungicidas, etc, aunque cada vez se utiliza menos con estos fines.
ANTIMONIO
¿QUE ES?
El antimonio difiere de los metales normales por tener una conductividad eléctrica menor en estado sólido que en estado líquido (como su compañero de grupo el bismuto). El antimonio metálico es muy quebradizo, de color blanco-azuloso con un brillo metálico característico, de apariencia escamosa. Aunque a temperaturas normales es estable al aire, cuando se calienta se quema en forma luminosa desprendiendo humos blancos de Sb2O3. La vaporización del metal forma moléculas de Sb4O6, que se descomponen en Sb2O3 por arriba de la temperatura de transición.
El antimonio se encuentra principalmente en la naturaleza como Sb2S3 (estibnita, antimonita); el Sb2O3 (valentinita) se halla como producto de descomposición de la estibnita. Forma parte por lo general de los minerales de cobre, plata y plomo. También se encuentran en la naturaleza los antimoniuros metálicos NiSb (breithaupita), NiSbS (ulmanita) y Ag2Sb (dicrasita); existen numerosos tioantimoniatos como el Ag3SbS3 (pirargirita).
El antimonio se obtiene calentando el sulfuro con hierro, o calentando el sulfuro y el sublimado de Sb4O6 obtenido se reduce con carbono; el antimonio de alta pureza se produce por refinado electrolítico.
El antimonio de grado comercial se utiliza en muchas aleaciones (1-20%), en especial de plomo, las cuales son más duras y resistentes mecánicamente que el plomo puro; casi la mitad de todo el antimonio producido se consume en acumuladores, revestimiento de cables, cojinetes antifricción y diversas clases de metales de consumo. La propiedad que tienen las aleaciones de Sn-Sb-Pb de dilatarse al enfriar el fundido permiten la producción de vaciados finos, que hacen útil este tipo de metal.
CARACTERISTICAS
El antimonio en su forma elemental es un sólido cristalino, fundible, quebradizo, blanco plateado que presenta una conductividad eléctrica y térmica baja y se evapora a bajas temperaturas. Este elemento semimetálico se parece a los metales en su aspecto y propiedades físicas, pero se comportan químicamente como un no metal. También puede ser atacado por ácidos oxidantes y halógenos.Las estimaciones sobre la abundancia de antimonio en la corteza terrestre van desde 0,2 a 0,5 ppm. El antimonio es calcófilo, presentándose con azufre y con otros elementos como plomo, cobre y plata.
El origen etimológico del antimonio proviene de los términos griegos anti y monos, que significa algo así como “el que no se encuentra solo”, pero la nominalización de su símbolo atómico (Sb) proviene del latín stibium, que significa “banco de arena gris brillante”. Se estima que el antimonio comenzó a utilizarse ampliamente en el siglo XVII; no obstante, se cree que en realidad se tiene conocimiento de este elemento desde la antigüedad.
Ahora bien, el antimonio es un metal plateado de un característico color gris brillante que pertenece al grupo de los metaloides en la tabla periódica de los elementos. Se trata de un elemento muy malo para la conducción del calor y también la electricidad, además, hay muchas formas compuestas de este metal que son considerablemente tóxicas.
Si bien es un metal poco abundante y rar vez se lo ha encontrado en estado natural, mínimas cantidades se de antimonio se pueden encontrar en unos 100 tipos de minerales diferentes, siendo el sulfuro de estibina su fuente principal. En su forma elemental, el antimonio se caracteriza por una estructura sólida y cristalina que se puede fundir y también quebrar con gran facilidad.
USOS
Usos metálicos:Desde que la batería eléctrica de plomo y ácido fue desarrollada en el siglo XIX, ha sido en gran medida la batería secundaria (o recargable) más importante por todo el mundo. Se utilizan en vehículos de motor, o como baterías industriales.
Las baterías eléctricas industriales incluyen las baterías de acumuladores de tracción en las locomotoras de las minas, carros del golf, y así sucesivamente, baterías de "energía de emergencia". El antimonio en aleación con el plomo es usado para ciertas piezas de los acumuladores eléctricos para las cuales la resistencia a la corrosión es necesaria.
El antimonio es un componente menor pero importante de muchas soldaduras suaves, que son las soldaduras que funden en temperaturas debajo del 625 K. Estas soldaduras pueden contener entre 0,5 y 3% de antimonio. La función del antimonio en estas soldaduras es consolidar la soldadura y suprimir la formación del alótropos de estaño a bajas temperatura, lo que degradaría de otra manera la integridad estructural de los empalmes soldados en las temperaturas debajo del punto de la transición de fase (289 K). El antimonio se ha utilizado como un endurecedor para el plomo usado en la munición.
En los Estados Unidos su uso se confina en gran parte a la fabricación de balas y perdigones. La contaminación del agua subterránea, del suelo y de la cadena trófica con el tóxico plomo ha preocupado por muchos años, y las regulaciones ambientales han conducido al reemplazo del plomo al antimonio con una aleación de tungsteno.
Las aleaciones de plomo que contienen cerca del 2 al 8% de antimonio son resistentes al uso atmosférico y la corrosión por lo que son utilizadas en la construcción de canales y barreras de la humedad. En la industria química, las aleaciones que contienen a partir 4 a 15 % de antimonio proporcionan la protección contra varios estados líquidos de los productos químicos, especialmente del ácido sulfúrico o del azufre. Aleado con bismuto, plomo y estaño, el antimonio es un componente de algunas de las aleaciones fusibles usadas en dispositivos de seguridad de fuego. El metal que se emplea para la fabricación de caracteres y demás material tipográfico se obtiene con una aleación de plomo, antimonio y estaño. El plomo se usa por la fácil fusión y para que la aleación sea dúctil y compacta. El antimonio sirve para dar más resistencia al metal con el fin de que no se aplaste tan fácilmente durante las repetidas y numerosas tiradas. Las aleaciones son diversas, según los tamaños de los tipos y el uso a que se destinan.
Así que para la fabricación del metal destinado a blancos, se suele usar la aleación siguiente, denominada ordinaria: 75 partes de plomo, 20 partes de antimonio y 5 partes de estaño. Cantidades pequeñas de antimonio de gran pureza se utilizan en los vídeo discos (DVD).
Usos no metálicos:
La punta de los fósforos de seguridad contiene trisulfuro de antimonio. La combustión es una reacción exotérmica mantenida por los radicales libres internamente generados y el calor radiante. Los retardadores con halógeno de la llama actúan interfiriendo con el mecanismo de cadena radical en la fase de gas (la llama). Cuando son utilizados por sí mismos, los retardadores de la llama del halógeno se deben utilizar en cantidades muy grandes. Este problema se evita agregando el trióxido del antimonio, que trabaja de forma conjunta con los halógenos, reduciendo la cantidad necesaria de retardante de llama y reduciendo también el coste del tratamiento total. El mecanismo del trabajo conjunto del antimonio y los halógenos se ha intentado explicar de varias maneras, pero ninguna es definitiva.
Muchos plásticos comunes son susceptibles a la degradación por el calor y la luz ultravioleta (UV) y se deben proteger durante la vida de servicio los productos hechos de ellos por la adición de compuestos conocidos como estabilizadores. El antimonio ha sido utilizado desde los años 1950 como estabilizador de calor eficaces para el PVC, especialmente en las formas rígidas del plástico.
El trióxido de antimonio se utiliza como catalizador en la polimerización del PET, que es un plástico usado en las botellas, películas, acondicionamiento de los alimentos, y muchos otros productos. Los compuestos del antimonio, junto con el dióxido de germanio, son los catalizadores preferidos para PET.
El dióxido de germanio da un producto con una transparencia mejor que el antimonio, pero que es demasiado costoso para muchas aplicaciones del PET. El trióxido de antimonio es utilizado también como pigmento blanco para las pinturas exteriores, donde su resistencia al desgaste por la acción atmosférica le hizo el objeto de valor, sin embargo, al descubrirse su capacidad tóxica el trióxido de antimonio ha sido suplantado por el dióxido de titanio (TiO2).
Todavía se utiliza en cantidades significativas como estabilizador del color, donde es importante mantener intensidad del color y evitar el cambio de la tonalidad, por ejemplo en las pinturas amarillas usadas para los autobuses de las escuelas (estadounidenses y sudafricanas) y en las rayas amarillas aplicadas a los pavimentos del camino.
Los pigmentos conductores de la electricidad del óxido de estaño (SnO) con antimonio se han introducido en años recientes para incorporarlos en las capas plásticas que protegen las computadoras y otros componentes electrónicos contra la electricidad estática.
El antimonio fue utilizado en medicina, por su buenas cualidades expectorantes, eméticas y purgantes. Y se llegaron a escribir tratados sobre sus cualidades médicas. Hasta que se decidió declararlo veneno, de forma oficial, el 3 de agosto de 1866. En forma de sales de antimonio Sb(OH)2Cl (Sbv) o como antimonio pentavalente, aún se menciona como tratamiento inicial contra leishmaniasis.
BISMUTO
¿QUE ES?
Elemento metálico, Bi, de número atómico 83 y peso atómico 208.980, pertenece al grupo Va de la tabla periódica. Es el elemento más metálico en este grupo, tanto en propiedades físicas como químicas. El único isótopo estable es el de masa 209. Se estima que la corteza terrestre contiene cerca de 0.00002% de bismuto. Existe en la naturaleza como metal libre y en minerales. Los principales depósitos están en Sudamérica, pero en Estados Unidos se obtiene principalmente como subproducto del refinado de los minerales de cobre y plomo.
El principal uso del bismuto está en la manufactura de aleaciones de bajo punto de fusión, que se emplean en partes fundibles de rociadoras automáticas, soldaduras especiales, sellos de seguridad para cilindros de gas comprimido y en apagadores automáticos de calentadores de agua eléctricos y de gas. Algunas aleaciones de bismuto que se expanden al congelarse se utilizan en fundición y tipos metálicos. Otra aplicación importante es la manufactura de compuestos farmacéuticos.
El bismuto es un metal cristalino, blanco grisáceo, lustroso, duro y quebradizo. Es uno de los pocos metales que se expanden al solidificarse. Su conductividad térmica es menor que la de cualquier otro metal, con excepción del mercurio. El bismuto es inerte al aire seco a temperatura ambiente, pero se oxida ligeramente cuando está húmedo. Forma rápidamente una película de óxido a temperaturas superiores a su punto de fusión, y se inflama al llegar al rojo formando el óxido amarillo, Bi2O3. El metal se combina en forma directa con los halógenos y con azufre, selenio y telurio, pero no con nitrógeno ni fósforo. No lo ataca el agua desgasificada a temperaturas comunes, pero se oxida lentamente al rojo por vapor de agua.
En casi todos los compuestos de bismuto está en forma trivalente. No obstante, en ocasiones puede ser pentavalente o monovalente. El bismutato de sodio y el pentafluoruro de bismuto son quizá los compuestos más importantes de Bi(V). El primero es un agente oxidante poderoso y el último un agente fluorante útil para compuestos orgánicos.
CARACTERÍSTICAS
Cuando es sólido flota sobre su estado líquido, por tener menor densidad en el estado sólido. Esta característica es compartida con el agua, el galio, el ácido acético, el antimonio y el silicio.
En casi todos los compuestos de bismuto aparece en forma trivalente, no obstante, en ocasiones puede ser pentavalente o monovalente. El bismutato de sodio y el pentafluoruro de bismuto son quizá los compuestos más importantes de Bi(V). El primero es un agente oxidante poderoso y el último un agente fluorante útil para compuestos orgánicos.
El átomo de bismuto se sigue considerando popularmente como el más pesado entre los átomos estables, ya que su tiempo de vida es varios millones la edad total del Universo, además de que, en teoría, todos los elementos químicos a partir del niobio están sujetos a fisión espontánea, es decir, todos los elementos con número superior al número 41 teóricamente pueden ser inestables, si bien en el bismuto la desintegración fue observado por estudios franceses en la última década. Es también el elemento no radiactivo monoatómico más pesado que existe.
El bismuto es uno de los dos peores conductores térmicos que existen entre todos los metales (junto al manganeso); es también el metal más diamagnético y sus aleaciones aprovechan ambas ventajas en situaciones donde se requiera. No existe de manera natural en el cuerpo humano ni en ninguna forma de vida en general. Se utiliza mucho en medicina, siendo parte de los astringentes recetados para problemas relacionados con el sistema digestivo, diarreas fuertes o irritaciones esofágicas, del colon, duodeno o intestinos.
Químicamente recuerda a los metales nobles y preciosos, se oxida con dificultad y se mantiene en algunos ácidos como el clorhídrico. Puede presentarse en estado nativo, hecho que refuerza su nobleza. El metal es gris con un muy ligero toque rosado, muy «vidrioso» y frágil, no soporta un impacto mínimo, su ductilidad y maleabilidad es nula. De no ser por su escasez, podría reemplazar al plomo como escudo antinuclear debido a la gran masa atómica que posee.
El bismuto se considera un metal pesado pero es irónicamente muy poco tóxico, prácticamente no agresivo, pese a estar rodeado de metales venenosos y peligrosos para el medioambiente. Sus cristales pueden ser trabajados hasta conseguir resultados de una increíble belleza. Oxidado en el laboratorio se consiguen maclas de iris fascinantes.
«El metal es muy caro teniendo en cuenta su escasez (igual a la del oro) y dificultad para encontrarlo. No parece demasiado importante en ningún sector de la industria o la medicina, pues se usa muy poco».
El bismuto será el último elemento en desintegrarse en el universo. La vida media del elemento se estima en 20 trillones de años.
USOS
Sustituto del plomo
La diferencia entre las densidades del plomo (densidad 11.32 g·cm−3) y del bismuto (densidad 9.78 g·cm−3) es lo suficientemente pequeña para que pueda ser utilizado en lugar del plomo en numerosos usos en balística y como balasto. Por ejemplo, puede reemplazar al plomo como material en plomadas para la pesca. Ha sido utilizado como sustituto del plomo en munición de perdigones, balines y balas para dispersar multitudes. Los Países Bajos, Dinamarca, Inglaterra, Gales y Estados Unidos y numerosos otros países han prohibido el uso de perdigones de plomo para la caza de aves acuáticas, ya que muchas aves sufrían de envenenamiento por plomo al ingerir material al confundir los perdigones con piedrecillas que ingieren para mejorar el funcionamiento de su sistema digestivo, o incluso han prohibido el uso de plomo en todo tipo de caza como es el caso de los Países Bajos. En estos casos ciertas aleaciones de bismuto-estaño ofrecen una alternativa con propiedades similares al plomo para uso en balística. Sin embargo, dado que el bismuto es muy poco maleable, no es un material adecuado para fabricar balas de caza del tipo expansivas.
Al ser el bismuto un elemento denso con un peso atómico elevado, es utilizado para fabricar escudos de látex impregnados con bismuto para protección de los rayos-X durante exámenes médicos, tales como tomografías computerizadas con rayos X, principalmente porque se le considera un elemento no tóxico.
La directiva de la Comunidad Europea sobre la restricción en cuanto al uso de sustancias peligrosas que impulsa la reducción en cuanto al uso del plomo, ha ampliado el uso del bismuto en la industria electrónica como uno de los componentes de las soldaduras con bajo punto de fusión, reemplazando a las soldaduras tradicionales a base de plomo-estaño. Su baja toxicidad es especialmente importante para aquellas soldaduras que se utilizan en la fabricación de equipos para procesamiento de alimentos y tuberías de cobre para agua.
Cosméticos y pigmentos
El oxicloruro de bismuto (BiOCl) a veces es utilizado en cosméticos, como pigmento en pintura para sombra de ojos, espray para el cabello y esmalte para uñas.151617 El compuesto se presenta en la naturaleza como el mineral bismoclita y la forma cristalina contiene capas de átomos que refractan la luz en forma cromática, produciendo un aspecto iridiscente similar al nácar de las perlas. Fue utilizado como cosmético en el antiguo Egipto y en muchas otras civilizaciones desde entonces. El término blanco de bismuto puede hacer referencia al oxicloruro de bismuto o al oxinitrato de bismuto (BiONO3), cuando son utilizados como pigmentos blancos.
GRUPO 6 DE LA TABLA PERIÓDICA
OXIGENO
¿QUE ES?
El oxígeno es un elemento químico de número atómico 8 y representado por el símbolo O. Su nombre proviene de las raíces griegas ὀξύς (oxys) («ácido», literalmente «punzante», en referencia al sabor de los ácidos) y –γόνος (-gonos) («productor», literalmente «engendrador»; es decir, "productor de ácidos"1), porque en la época en que se le dio esta denominación se creía, incorrectamente, que todos los ácidos requerían oxígeno para su composición. En condiciones normales de presión y temperatura, dos átomos del elemento se enlazan para formar el dioxígeno, un gas diatómico incoloro, inodoro e insípido con fórmula O2. Esta sustancia constituye una importante parte de la atmósfera y resulta necesaria para sostener la vida terrestre.
Forma parte del grupo de los anfígenos en la tabla periódica y es un elemento no metálico altamente reactivo que forma fácilmente compuestos (especialmente óxidos) con la mayoría de elementos, excepto con los gases nobles helio y neón. Asimismo, es un fuerte agente oxidante y tiene la segunda electronegatividad más alta de todos los elementos, solo superada por el flúor.2 Medido por su masa, el oxígeno es el tercer elemento más abundante del universo, tras el hidrógeno y el helio,3 y el más abundante en la corteza terrestre ya que forma, prácticamente, la mitad de su masa.Debido a su reactividad química, no puede permanecer en la atmósfera terrestre como elemento libre sin ser reabastecido constantemente por la acción fotosintética de los organismos que utilizan la energía solar para producir oxígeno elemental a partir del agua. El oxígeno elemental O2 solamente empezó a acumularse en la atmósfera después de la aparición de estos organismos, aproximadamente hace 2500 millones de años. El oxígeno diatómico constituye el 20,8 % del volumen de la atmósfera terrestre.
Dado que constituye la mayor parte de la masa del agua, es también el componente mayoritario de la masa de los seres vivos. Muchas de las moléculas más importantes que forman parte de los seres vivos, como las proteínas, los ácidos nucleicos, los carbohidratos y los lípidos, contienen oxígeno, así como los principales compuestos inorgánicos que forman los caparazones, dientes y huesos animales. El oxígeno elemental se produce por cianobacterias, algas y plantas y todas las formas complejas de vida lo usan para su respiración celular. Resulta tóxico para los organismos de tipo anaerobio obligado, las formas tempranas de vida que predominaban en la Tierra hasta que el O2 comenzó a acumularse en la atmósfera. Otra forma (alótropa) del oxígeno, el ozono (O3), ayuda a proteger la biosfera de la radiación ultravioleta a gran altitud, en la llamada capa de ozono, pero es contaminante cerca de la superficie, donde es un subproducto del esmog. A altitudes aún mayores de la órbita baja terrestre, el oxígeno atómico tiene una presencia significativa y causa erosión en las naves espaciales.
Carl Wilhelm Scheele descubrió el oxígeno de forma independiente en Upsala en 1773, o incluso antes, y Joseph Priestley, en Wiltshire en 1774, pero el honor suele adjudicársele a Priestley debido a que publicó su trabajo antes. Antoine Lavoisier, cuyas investigaciones ayudaron a desacreditar la entonces popular teoría del flogisto de combustión y corrosión, acuñó el nombre «oxígeno» en 1777.8 Este se produce industrialmente mediante la destilación fraccionada de aire licuado, el uso de zeolita con ciclos de presión para concentrar el oxígeno del aire, la electrólisis del agua y otros medios. El oxígeno se utiliza en la producción de acero, plásticos y textiles; los propulsores de cohetes; la oxigenoterapia; y la asistencia para la respiración en aeronaves, submarinos, vuelos espaciales y submarinismo.
Forma parte del grupo de los anfígenos en la tabla periódica y es un elemento no metálico altamente reactivo que forma fácilmente compuestos (especialmente óxidos) con la mayoría de elementos, excepto con los gases nobles helio y neón. Asimismo, es un fuerte agente oxidante y tiene la segunda electronegatividad más alta de todos los elementos, solo superada por el flúor.2 Medido por su masa, el oxígeno es el tercer elemento más abundante del universo, tras el hidrógeno y el helio,3 y el más abundante en la corteza terrestre ya que forma, prácticamente, la mitad de su masa.Debido a su reactividad química, no puede permanecer en la atmósfera terrestre como elemento libre sin ser reabastecido constantemente por la acción fotosintética de los organismos que utilizan la energía solar para producir oxígeno elemental a partir del agua. El oxígeno elemental O2 solamente empezó a acumularse en la atmósfera después de la aparición de estos organismos, aproximadamente hace 2500 millones de años. El oxígeno diatómico constituye el 20,8 % del volumen de la atmósfera terrestre.
Dado que constituye la mayor parte de la masa del agua, es también el componente mayoritario de la masa de los seres vivos. Muchas de las moléculas más importantes que forman parte de los seres vivos, como las proteínas, los ácidos nucleicos, los carbohidratos y los lípidos, contienen oxígeno, así como los principales compuestos inorgánicos que forman los caparazones, dientes y huesos animales. El oxígeno elemental se produce por cianobacterias, algas y plantas y todas las formas complejas de vida lo usan para su respiración celular. Resulta tóxico para los organismos de tipo anaerobio obligado, las formas tempranas de vida que predominaban en la Tierra hasta que el O2 comenzó a acumularse en la atmósfera. Otra forma (alótropa) del oxígeno, el ozono (O3), ayuda a proteger la biosfera de la radiación ultravioleta a gran altitud, en la llamada capa de ozono, pero es contaminante cerca de la superficie, donde es un subproducto del esmog. A altitudes aún mayores de la órbita baja terrestre, el oxígeno atómico tiene una presencia significativa y causa erosión en las naves espaciales.
Carl Wilhelm Scheele descubrió el oxígeno de forma independiente en Upsala en 1773, o incluso antes, y Joseph Priestley, en Wiltshire en 1774, pero el honor suele adjudicársele a Priestley debido a que publicó su trabajo antes. Antoine Lavoisier, cuyas investigaciones ayudaron a desacreditar la entonces popular teoría del flogisto de combustión y corrosión, acuñó el nombre «oxígeno» en 1777.8 Este se produce industrialmente mediante la destilación fraccionada de aire licuado, el uso de zeolita con ciclos de presión para concentrar el oxígeno del aire, la electrólisis del agua y otros medios. El oxígeno se utiliza en la producción de acero, plásticos y textiles; los propulsores de cohetes; la oxigenoterapia; y la asistencia para la respiración en aeronaves, submarinos, vuelos espaciales y submarinismo.
CARACTERISTICAS
En condiciones normales de presión y temperatura, el oxígeno es un gas incoloro e inodoro con fórmula molecular O2, en el que dos átomos de oxígeno se enlazan con una configuración electrónica en estado triplete. Este enlace tiene un orden de enlace de dos y se suele simplificar en las descripciones como un enlace doble9 o como una combinación de un enlace de dos electrones y dos enlaces de tres electrones.10
El oxígeno triplete —no debe confundirse con el ozono, O3— es el estado fundamental de la molécula O2,11 que cuenta con dos electrones desparejados que ocupan dos orbitales moleculares degenerados.nota 1 Estos orbitales se clasifican como antienlaces —debilitan el orden de enlace de tres a dos—, de manera que el enlace del dioxígeno es más débil que el triple enlace del nitrógeno diatómico, en el que todos los orbitales de los enlaces moleculares se rellenan, pero algunos orbitales de antienlace no lo están.11
En su forma normal de triplete, las moléculas de O2 son paramagnéticas; es decir, que en presencia de un campo magnético forman un imán, debido al momento magnético del espín de los electrones desparejados en la molécula y la interacción de canje negativa entre moléculas de O2 contiguas.12 Un imán atrae al oxígeno líquido hasta tal punto que, en demostraciones de laboratorio, un hilo de oxígeno líquido puede sostenerse contra su propio peso entre los polos de un imán potente.13nota 2
El oxígeno molecular singlete es un nombre dado a varias especies de O2 de mayor energía, en las que todos los espínes de los electrones se emparejan. Es mucho más reactivo con moléculas orgánicas habituales que el oxígeno molecular en sí mismo. En la naturaleza, el oxígeno singlete se suele formar con el agua en la fotosíntesis, usando la energía solar.15 También se produce en la troposfera a causa de la fotolisis del ozono por la luz de onda corta,16 así como por el sistema inmunitario como una fuente de oxígeno activo.17 En los organismos fotosintéticos —y posiblemente también en los animales—, los carotenoides juegan un papel fundamental en la absorción de energía del oxígeno singlete y la conversión de este a su estado no excitado antes de que pueda causar daño a los tejidos.
El oxígeno es más soluble en agua que el nitrógeno; esta contiene aproximadamente una molécula de O2 por cada dos moléculas de N2,27 comparado con la proporción en la atmósfera, que viene a ser de 1:4. La solubilidad del oxígeno en el agua depende de la temperatura, disolviéndose alrededor del doble (14,6 mg•L−1) a 0 °C que a 20 °C (7,6 mg•L−1).1228 A 25 °C y 1 atmósfera de presión, el agua dulce contiene alrededor de 6,04 mililitros (ml) de oxígeno por litro, mientras que el agua marina contiene alrededor de 4,95 ml por litro.29 A 5 °C la solubilidad se incrementa hasta 9,0 ml (un 50 % más que a 25 °C) por litro en el agua y 7,2 ml (45 % más) en el agua de mar.
El oxígeno se condensa a 90,20 K (−182,95 °C, −297,31 °F) y se congela a 54,36 K (−218,79 °C, −361,82 °F).30 Tanto el O2 líquido como el sólido son sustancias con un suave color azul cielo causado por la absorción en el rojo, en contraste con el color azul del cielo, que se debe a la dispersión de Rayleigh de la luz azul. El O2 líquido de gran pureza se suele obtener a través de la destilación fraccionada de aire licuado.31 El oxígeno líquido también puede producirse por condensación del aire, usando nitrógeno líquido como refrigerante. Es una sustancia altamente reactiva y debe separarse de materiales inflamables.
El oxígeno triplete —no debe confundirse con el ozono, O3— es el estado fundamental de la molécula O2,11 que cuenta con dos electrones desparejados que ocupan dos orbitales moleculares degenerados.nota 1 Estos orbitales se clasifican como antienlaces —debilitan el orden de enlace de tres a dos—, de manera que el enlace del dioxígeno es más débil que el triple enlace del nitrógeno diatómico, en el que todos los orbitales de los enlaces moleculares se rellenan, pero algunos orbitales de antienlace no lo están.11
En su forma normal de triplete, las moléculas de O2 son paramagnéticas; es decir, que en presencia de un campo magnético forman un imán, debido al momento magnético del espín de los electrones desparejados en la molécula y la interacción de canje negativa entre moléculas de O2 contiguas.12 Un imán atrae al oxígeno líquido hasta tal punto que, en demostraciones de laboratorio, un hilo de oxígeno líquido puede sostenerse contra su propio peso entre los polos de un imán potente.13nota 2
El oxígeno molecular singlete es un nombre dado a varias especies de O2 de mayor energía, en las que todos los espínes de los electrones se emparejan. Es mucho más reactivo con moléculas orgánicas habituales que el oxígeno molecular en sí mismo. En la naturaleza, el oxígeno singlete se suele formar con el agua en la fotosíntesis, usando la energía solar.15 También se produce en la troposfera a causa de la fotolisis del ozono por la luz de onda corta,16 así como por el sistema inmunitario como una fuente de oxígeno activo.17 En los organismos fotosintéticos —y posiblemente también en los animales—, los carotenoides juegan un papel fundamental en la absorción de energía del oxígeno singlete y la conversión de este a su estado no excitado antes de que pueda causar daño a los tejidos.
El oxígeno es más soluble en agua que el nitrógeno; esta contiene aproximadamente una molécula de O2 por cada dos moléculas de N2,27 comparado con la proporción en la atmósfera, que viene a ser de 1:4. La solubilidad del oxígeno en el agua depende de la temperatura, disolviéndose alrededor del doble (14,6 mg•L−1) a 0 °C que a 20 °C (7,6 mg•L−1).1228 A 25 °C y 1 atmósfera de presión, el agua dulce contiene alrededor de 6,04 mililitros (ml) de oxígeno por litro, mientras que el agua marina contiene alrededor de 4,95 ml por litro.29 A 5 °C la solubilidad se incrementa hasta 9,0 ml (un 50 % más que a 25 °C) por litro en el agua y 7,2 ml (45 % más) en el agua de mar.
El oxígeno se condensa a 90,20 K (−182,95 °C, −297,31 °F) y se congela a 54,36 K (−218,79 °C, −361,82 °F).30 Tanto el O2 líquido como el sólido son sustancias con un suave color azul cielo causado por la absorción en el rojo, en contraste con el color azul del cielo, que se debe a la dispersión de Rayleigh de la luz azul. El O2 líquido de gran pureza se suele obtener a través de la destilación fraccionada de aire licuado.31 El oxígeno líquido también puede producirse por condensación del aire, usando nitrógeno líquido como refrigerante. Es una sustancia altamente reactiva y debe separarse de materiales inflamables.
USOS
Medicina
Artículo principal: Oxigenoterapia
El propósito esencial de la respiración es tomar el O2 del aire y, en medicina, se usan suplementos de oxígeno. El tratamiento no solo incrementa los niveles de oxígeno en la sangre del paciente, sino que tiene el efecto secundario de disminuir la resistencia al flujo de la sangre en muchos tipos de pulmones enfermos, lo que facilita el trabajo de bombeo del corazón. La oxigenoterapia se usa para tratar el enfisema, la neumonía, algunas insuficiencias cardíacas, algunos desórdenes que causan una elevada presión arterial pulmonar y cualquier enfermedad que afecte a la capacidad del cuerpo para tomar y usar el oxígeno.72
Los tratamientos son lo suficientemente flexibles como para ser usados en hospitales, la vivienda del paciente o, cada vez más, con instrumentos móviles. Así, las tiendas de oxígeno se solían usar como suplementos de oxígeno, pero han ido sustituyéndose por las máscaras de oxígeno y las cánulas nasales.73
La medicina hiperbárica (de alta presión) usa cámaras especiales de oxígeno para aumentar la presión parcial del O2 en el paciente y, cuando son necesarias, en el personal médico.74 La intoxicación por monóxido de carbono, la mionecrosis (gangrena gaseosa) y el síndrome de descompresión a veces se tratan con estos aparatos.75 El aumento de la concentración del O2 en los pulmones ayuda a desplazar el monóxido de carbono del hemogrupo de hemoglobina.7677 El oxígeno es tóxico para la bacteria anaerobia que causa la gangrena gaseosa, de manera que aumentar su presión parcial ayuda a acabar con ellas.7879 El síndrome de descompresión les sucede a los buzos que salen demasiado rápido del mar, lo que resulta en la formación de burbujas de gas inerte, sobre todo nitrógeno, en su sangre.728081
También se usa oxígeno para pacientes que necesitan ventilación mecánica, normalmente a concentraciones superiores al 21 % encontrado en el aire ambiental. Por otra parte, el isótopo 15O se usó de forma experimental en la tomografía por emisión de positrones.
Apoyo vital y uso recreativo
En los trajes espaciales se usa O2 a baja presión.
Una aplicación notable del O2 como gas respirable de baja presión se encuentra en los trajes espaciales modernos, que envuelven el cuerpo de sus ocupantes con aire presurizado. Estos dispositivos usan oxígeno casi puro a una presión de alrededor de un tercio de la común, lo que da como resultado una presión parcial normal en el O2 de la sangre. Este intercambio de oxígeno de alta concentración para una baja presión es necesario para mantener la flexibilidad de los trajes espaciales.
Los buceadores y los tripulantes de submarinos también usan O2 artificialmente proporcionado, pero la mayoría usan una presión normal o una mezcla de oxígeno y aire. El uso de O2 puro o casi puro en buceo a presiones por encima del nivel del mar se limita generalmente a los descansos, descompresiones y tratamientos de emergencia a relativamente poca profundidad (~6 metros o menos).El buceo a mayor profundidad requiere una dilución significativa de O2 con otros gases, como nitrógeno o helio, para ayudar a prevenir el efecto de Paul Bert (toxicidad del oxígeno).
Los escaladores de montaña y los que viajan en aviones no presurizados a veces tienen un suplemento de O2.nota 12 Los pasajeros de aviones comerciales (presurizados) tienen un suministro de O2 para emergencias, que les es puesto automáticamente a su disposición en caso de despresurización de la cabina. Una pérdida repentina de presión en la cabina activa generadores químicos de oxígeno sobre cada asiento y hace caer máscaras de oxígeno. Al tirar de la máscara para comenzar el flujo de oxígeno, tal y como indican las instrucciones de seguridad, se fuerzan las limaduras de hierro en el clorato de sodio dentro del recipiente.Se produce, entonces, un chorro constante de oxígeno debido a la reacción exotérmica.
El oxígeno, como un supuesto eufórico suave, tiene una historia de uso recreativo en deportes y bares de oxígeno. Estos son establecimientos que aparecieron en Japón, California y Las Vegas a finales de los años 1990 que ofertan exposiciones a niveles de O2 superiores a lo normal a cambio de una determinada tarifa.87 Los atletas profesionales, especialmente en fútbol americano, también salen del campo en ocasiones, durante los descansos, para ponerse máscaras de oxígeno y obtener una estimulación en su juego. El efecto farmacológico es dudoso y el efecto placebo es la explicación más factible. Existen estudios que respaldan esa estimulación con mezclas de O2 enriquecido, pero solo si se inhalan durante el ejercicio aeróbico.
Artículo principal: Oxigenoterapia
El propósito esencial de la respiración es tomar el O2 del aire y, en medicina, se usan suplementos de oxígeno. El tratamiento no solo incrementa los niveles de oxígeno en la sangre del paciente, sino que tiene el efecto secundario de disminuir la resistencia al flujo de la sangre en muchos tipos de pulmones enfermos, lo que facilita el trabajo de bombeo del corazón. La oxigenoterapia se usa para tratar el enfisema, la neumonía, algunas insuficiencias cardíacas, algunos desórdenes que causan una elevada presión arterial pulmonar y cualquier enfermedad que afecte a la capacidad del cuerpo para tomar y usar el oxígeno.72
Los tratamientos son lo suficientemente flexibles como para ser usados en hospitales, la vivienda del paciente o, cada vez más, con instrumentos móviles. Así, las tiendas de oxígeno se solían usar como suplementos de oxígeno, pero han ido sustituyéndose por las máscaras de oxígeno y las cánulas nasales.73
La medicina hiperbárica (de alta presión) usa cámaras especiales de oxígeno para aumentar la presión parcial del O2 en el paciente y, cuando son necesarias, en el personal médico.74 La intoxicación por monóxido de carbono, la mionecrosis (gangrena gaseosa) y el síndrome de descompresión a veces se tratan con estos aparatos.75 El aumento de la concentración del O2 en los pulmones ayuda a desplazar el monóxido de carbono del hemogrupo de hemoglobina.7677 El oxígeno es tóxico para la bacteria anaerobia que causa la gangrena gaseosa, de manera que aumentar su presión parcial ayuda a acabar con ellas.7879 El síndrome de descompresión les sucede a los buzos que salen demasiado rápido del mar, lo que resulta en la formación de burbujas de gas inerte, sobre todo nitrógeno, en su sangre.728081
También se usa oxígeno para pacientes que necesitan ventilación mecánica, normalmente a concentraciones superiores al 21 % encontrado en el aire ambiental. Por otra parte, el isótopo 15O se usó de forma experimental en la tomografía por emisión de positrones.
Apoyo vital y uso recreativo
En los trajes espaciales se usa O2 a baja presión.
Una aplicación notable del O2 como gas respirable de baja presión se encuentra en los trajes espaciales modernos, que envuelven el cuerpo de sus ocupantes con aire presurizado. Estos dispositivos usan oxígeno casi puro a una presión de alrededor de un tercio de la común, lo que da como resultado una presión parcial normal en el O2 de la sangre. Este intercambio de oxígeno de alta concentración para una baja presión es necesario para mantener la flexibilidad de los trajes espaciales.
Los buceadores y los tripulantes de submarinos también usan O2 artificialmente proporcionado, pero la mayoría usan una presión normal o una mezcla de oxígeno y aire. El uso de O2 puro o casi puro en buceo a presiones por encima del nivel del mar se limita generalmente a los descansos, descompresiones y tratamientos de emergencia a relativamente poca profundidad (~6 metros o menos).El buceo a mayor profundidad requiere una dilución significativa de O2 con otros gases, como nitrógeno o helio, para ayudar a prevenir el efecto de Paul Bert (toxicidad del oxígeno).
Los escaladores de montaña y los que viajan en aviones no presurizados a veces tienen un suplemento de O2.nota 12 Los pasajeros de aviones comerciales (presurizados) tienen un suministro de O2 para emergencias, que les es puesto automáticamente a su disposición en caso de despresurización de la cabina. Una pérdida repentina de presión en la cabina activa generadores químicos de oxígeno sobre cada asiento y hace caer máscaras de oxígeno. Al tirar de la máscara para comenzar el flujo de oxígeno, tal y como indican las instrucciones de seguridad, se fuerzan las limaduras de hierro en el clorato de sodio dentro del recipiente.Se produce, entonces, un chorro constante de oxígeno debido a la reacción exotérmica.
El oxígeno, como un supuesto eufórico suave, tiene una historia de uso recreativo en deportes y bares de oxígeno. Estos son establecimientos que aparecieron en Japón, California y Las Vegas a finales de los años 1990 que ofertan exposiciones a niveles de O2 superiores a lo normal a cambio de una determinada tarifa.87 Los atletas profesionales, especialmente en fútbol americano, también salen del campo en ocasiones, durante los descansos, para ponerse máscaras de oxígeno y obtener una estimulación en su juego. El efecto farmacológico es dudoso y el efecto placebo es la explicación más factible. Existen estudios que respaldan esa estimulación con mezclas de O2 enriquecido, pero solo si se inhalan durante el ejercicio aeróbico.
Industria
La mayor parte del O2 producido con propósito comercial se utiliza para la fundición del Hierro en acero.
La fundición de mena de hierro en acero consume el 55 % del oxígeno producido comercialmente.40 En este proceso, el O2 es inyectado mediante una lanza de alta presión en el molde de hierro, que expulsa las impurezas de Azufre y el exceso de Carbono, en forma de sus respectivos óxidos, SO2 y CO2. Las reacciones son exotérmicas y la temperatura asciende hasta los 1700 Cº.40
Otro 25 % de este oxígeno se dedica a la industria química.40 El etileno reacciona con el O2 para crear óxido de etileno, que, a su vez, se convierte en etilenglicol, el material usado como base para fabricar una gran variedad de productos, entre otros los anticongelantes y los polímeros de poliéster (los precursores de muchos plásticos y textiles).
El oxígeno se usa en el oxicorte quemando acetileno con O2 para producir una llama muy caliente. En este proceso, el metal de hasta 60 centímetros de grosor se calienta primero con una pequeña llama de oxiacetileno para después ser rápidamente cortado por un gran chorro de O2.
Ciencia
Los paleoclimatólogos miden la relación entre el oxígeno-18 y el oxígeno-16 en los esqueletos y exoesqueletos de los organismos marinos para determinar cómo era el clima hace millones de años. Las moléculas de agua de mar que contienen el isótopo más ligero, el oxígeno-16, se evaporan a un ritmo ligeramente mayor que las moléculas que contienen oxígeno-18 (un 12 % más pesado); esta disparidad se incrementa a bajas temperaturas. En periodos con una temperatura global más baja, la nieve y la lluvia procedentes de esa agua evaporada tienden a ser más ricas en oxígeno-16, mientras que el agua marina que queda tiende a serlo en oxígeno-18. Los organismos marinos, por tanto, incorporan más oxígeno-18 en sus esqueletos y exoesqueletos de lo que harían en un medio más cálido.Los paleoclimatólogos también miden directamente esta relación en las moléculas de agua de muestras de núcleo de hielo que se han coservado durante varios cientos de miles de años.
Los geólogos planetarios han medido las diferencias en la abundancia de isótopos de oxígeno en muestras de la Tierra, la Luna, Marte y meteoritos, pero no han estado lejos de poder obtener valores de referencia para las relaciones entre isótopos del Sol, que se creen iguales a aquellas de la nebulosa protosolar. Sin embargo, el análisis de una oblea de Silicio expuesta al viento solar en el espacio y devuelta a la Tierra por la sonda Génesis desveló que el Sol tiene una proporción de oxígeno-16 mayor que nuestro planeta. La medición implica que un proceso desconocido agotó el oxígeno-16 del disco protoplanetario del Sol antes de la fusión de los granos de polvo que formaron la Tierra.
AZUFRE
Elemento químico, S, de número atómico 16. Los isótopos estables conocidos y sus porcentajes aproximados de abundancia en el azufre natural son éstos: 32S (95.1%); 33S (0.74%); 34S (4.2%) y 36S (0.016%). La proporción del azufre en la corteza terrestre es de 0.03-0.1%. Con frecuencia se encuentra como elemento libre cerca de las regiones volvánicas (depósitos impuros).
Propiedades: Los alótropos del azufre (diferentes formas cristalinas) han sido estudiados ampliamente, pero hasta ahora las diversas modificaciones en las cuales existen para cada estado (gas, líquido y sólido) del azufre elemental no se han dilucidado por completo.
El azufre rómbico, llamado también azufre y azufre alfa, es la modificación estable del elemento por debajo de los 95.5ºC (204ºF, el punto de transición), y la mayor parte de las otras formas se revierten a esta modificación si se las deja permanecer por debajo de esta temperatura. El azufre rómbico es de color amarillo limón, insoluble en agua, ligeramente soluble en alcohol etílico, éter dietílico y benceno, y es muy soluble en disulfuro de carbono. Su densidad es 2.07 g/cm3 (1.19 oz/in3) y su dureza es de 2.5 en la escala de Mohs. Su fórmula molecular es S8.
El azufre monoclínico, llamado también azufre prismático y azufre beta, es la modificación estable del elemento por encima de la temperatura de transición y por debajo del punto de fusión.
El azufre fundido se cristaliza en prismas en forma de agujas que son casi incoloras. Tiene una densidad de 1.96 g/cm3 (1.13 oz/in3) y un punto de fusión de 119.0ºC (246.7ºF). Su fórmula molecular también es S8.
El azufre plástico, denominado también azufre gamma, se produce cuando el azufre fundido en el punto de ebullición normal o cerca de él es enfriado al estado sólido. Esta froma es amorfa y es sólo parcialmente soluble en disulfuro de carbono.
El azufre líquido posee la propiedad notable de aumentar su viscosidad si sube la temperatura. Su color cambia a negro rojizo oscuro cuando su viscosidad aumenta, y el oscurecimiento del color y la viscosidad logran su máximo a 200ºC (392ºF). Por encima de esta temperatura, el color se aclara y la viscosidad disminuye.
En le punto normal de ebullición del elemento (444.60ºC u 832.28ºF) el azufre gaseoso presenta un color amarillo naranja. Cuando la temperatura aumenta, el color se torna rojo profundo y después se aclara, aproximadamente a 650º (202ºF), y adquiere un color amarillo paja.
El azufre es un elemento activo que se combina directamente con la mayor parte de los elementos conocidos. Puede existir tanto en estados de oxidación positivos como negativos, y puede forma compuestos iónicos así como covalentes y covalentes coordinados. Sus empleos se limitan principalmente a la producción de compuestos de azufre. Sin embargo, grandes cantidades de azufre elemental se utilizan en la vulcanización del caucho, en atomizadores con azufre para combatir parásitos de las plantas, en la manufactura de fertilizantes artificiales y en ciertos tipos de cementos y aislantes eléctricos, en algunos ungüentos y medicinas y en la manufactura de pólvora y fósforos. Los compuestos de azufre se emplean en la manufactura de productos químicos, textiles, jabones, fertilizantes, pieles, plásticos, refrigerantes, agentes blanqueadores, drogas, tintes, pinturas, papel y otros productos.
CARACTERISTICAS
Este no metal tiene un color amarillento fuerte, amarronado o anaranjado y arde con llama de color azul, desprendiendo dióxido de azufre. Es insoluble en agua pero se disuelve en disulfuro de carbono y benceno. Es multivalente, y son comunes los estados de oxidación -2, +2, +4, +6.
En todos los estados (sólido, líquido y gaseoso): según los químicos presenta formas alotrópicas cuyas relaciones no son completamente conocidas. Las estructuras cristalinas más comunes son el octaedro ortorrómbico (azufre α) y el prisma monoclínico (azufre β), siendo la temperatura de transición de una a otra de 96 °C; en ambos casos el azufre se encuentra formando moléculas de S8 con forma de anillo, y es la diferente disposición de estas moléculas la que provoca las distintas estructuras cristalinas. A temperatura ambiente, la transformación del azufre monoclínico en ortorrómbico, es más estable y muy lenta.
Al fundir el azufre, se obtiene un líquido que fluye con facilidad formado por moléculas de S8. Sin embargo, si se calienta, el color se torna marrón algo rojizo, y se incrementa la viscosidad. Este comportamiento se debe a la ruptura de los anillos y la formación de largas cadenas de átomos de azufre, que pueden alcanzar varios miles de átomos de longitud, que se enredan entre sí disminuyendo la fluidez del líquido; el máximo de la viscosidad se alcanza en torno a los 200 °C. Enfriando rápidamente este líquido viscoso se obtiene una masa elástica, de consistencia similar a la de la goma, denominada «azufre plástico» (azufre γ) formada por cadenas que no han tenido tiempo de reordenarse para formar moléculas de S8; transcurrido cierto tiempo la masa pierde su elasticidad cristalizando en el sistema rómbico. Estudios realizados con rayos X muestran que esta forma deforme puede estar constituida por moléculas de S8 con estructura de hélice espiral.
En estado vapor también forma moléculas de S8, pero a 780 °C ya se alcanza el equilibrio con moléculas diatómicas y por encima de aproximadamente 1800 °C la disociación es completa y se encuentran átomos de azufre.
Además de en trozos, barras o polvo grueso, existe en el mercado una presentación en forma de polvo muy fino, llamada "Flor de azufre", que puede obtenerse por precipitación en medio líquido o por sublimación de su vapor sobre una placa metálica fría. Estas son sus reacciones: S+Zn=ZnS 2Al+3S=Al²S³ S+O²=SO² 6S+HNO³=H²SO⁴+6NO²+2H²O
En todos los estados (sólido, líquido y gaseoso): según los químicos presenta formas alotrópicas cuyas relaciones no son completamente conocidas. Las estructuras cristalinas más comunes son el octaedro ortorrómbico (azufre α) y el prisma monoclínico (azufre β), siendo la temperatura de transición de una a otra de 96 °C; en ambos casos el azufre se encuentra formando moléculas de S8 con forma de anillo, y es la diferente disposición de estas moléculas la que provoca las distintas estructuras cristalinas. A temperatura ambiente, la transformación del azufre monoclínico en ortorrómbico, es más estable y muy lenta.
Al fundir el azufre, se obtiene un líquido que fluye con facilidad formado por moléculas de S8. Sin embargo, si se calienta, el color se torna marrón algo rojizo, y se incrementa la viscosidad. Este comportamiento se debe a la ruptura de los anillos y la formación de largas cadenas de átomos de azufre, que pueden alcanzar varios miles de átomos de longitud, que se enredan entre sí disminuyendo la fluidez del líquido; el máximo de la viscosidad se alcanza en torno a los 200 °C. Enfriando rápidamente este líquido viscoso se obtiene una masa elástica, de consistencia similar a la de la goma, denominada «azufre plástico» (azufre γ) formada por cadenas que no han tenido tiempo de reordenarse para formar moléculas de S8; transcurrido cierto tiempo la masa pierde su elasticidad cristalizando en el sistema rómbico. Estudios realizados con rayos X muestran que esta forma deforme puede estar constituida por moléculas de S8 con estructura de hélice espiral.
En estado vapor también forma moléculas de S8, pero a 780 °C ya se alcanza el equilibrio con moléculas diatómicas y por encima de aproximadamente 1800 °C la disociación es completa y se encuentran átomos de azufre.
Además de en trozos, barras o polvo grueso, existe en el mercado una presentación en forma de polvo muy fino, llamada "Flor de azufre", que puede obtenerse por precipitación en medio líquido o por sublimación de su vapor sobre una placa metálica fría. Estas son sus reacciones: S+Zn=ZnS 2Al+3S=Al²S³ S+O²=SO² 6S+HNO³=H²SO⁴+6NO²+2H²O
USOS
El azufre se usa en multitud de procesos industriales, como la producción de ácido sulfúrico para baterías, la fabricación de pólvora y el vulcanizado del caucho.
Los sulfitos se usan para blanquear el papel y en fósforos. El tiosulfato de sodio o amonio se emplea en la industria fotográfica como «fijador» ya que disuelve el bromuro de plata; y el sulfato de magnesio (sal de Epsom) tiene usos diversos como laxante, exfoliante, o suplemento nutritivo para plantas.
También el azufre se emplea en la industria enológica como antiséptico. Uno de sus principales usos es como anhídrido sulfuroso.
El azufre tiene usos como fungicida y en la manufactura de fosfatos fertilizantes.
SELENIO
Elemento químico, símbolo Se, número atómico 34 y peso atómico 78.96. Sus propiedades son semejantes a las del telurio.
La abundancia de este elemento, ampliamente distribuido en la corteza terrestre, se estima aproximadamente en 7 x 10-5% por peso, encontrándose en forma de seleniuros de elementos pesados y, en menor cantidad, como elemento libre en asociación con azufre elemental. Sus minerales no se encuentran en suficiente cantidad para tener utilidad, como fuente comercial del elemento, y por ello los minerales de sulfuro de cobre seleníferos son los que representan la fuente primaria.
Los empleos más importantes del selenio son el proceso de fotocopiado xerográfico, la decoloración de vidrios teñidos por compuestos de hierro, y también se usa como pigmento en plásticos, pinturas, barnices, vidrio y cerámica y tintas. Su utilización en rectificadores ha disminuido por el mayor empleo del silicio y el germanio en esta aplicación. El selenio se emplea también en exposímetros fotográficos y como aditivo metalúrgico que mejora la capacidad de ciertos aceros para ser maquinados.
El selenio arde en el aire con una flama azul para dar dióxido de selenio, SeO2. El elemento también reacciona directamente con diversos metales y no metales, entre ellos el hidrógeno y los halógenos. Los ácidos no oxidantes, no reaccionan con el selenio; pero el ácido nítrico, el ácido sulfúrico concentrado y los hidróxidos alcalinos fuertes lo disuelven.
El único compuesto importante del selenio con hidrógeno es el seleniuro de hidrógeno, H2Se, gas venenoso incoloro e inflamable con un olor desagradable, gran toxicidad y estabilidad térmica menor que la del sulfuro de hidrógeno. Disuelto en agua, el seleniuro de hidrógeno puede precipitar muchos iones de metales pesados como seleniuros muy poco solubles. Los compuestos orgánicos con enlaces C-Se son muchos e incluyen desde simples selenoles, RSeH; ácido selenénico, RseOH; haluros organil selénicos, RSeX; seleniuros diorganílicos y diseleniuros, R2Se y R2Se2, hasta moléculas que exhiben actividad biológica, como los selenoaminoácidos y los selenopéptidos.
La abundancia de este elemento, ampliamente distribuido en la corteza terrestre, se estima aproximadamente en 7 x 10-5% por peso, encontrándose en forma de seleniuros de elementos pesados y, en menor cantidad, como elemento libre en asociación con azufre elemental. Sus minerales no se encuentran en suficiente cantidad para tener utilidad, como fuente comercial del elemento, y por ello los minerales de sulfuro de cobre seleníferos son los que representan la fuente primaria.
Los empleos más importantes del selenio son el proceso de fotocopiado xerográfico, la decoloración de vidrios teñidos por compuestos de hierro, y también se usa como pigmento en plásticos, pinturas, barnices, vidrio y cerámica y tintas. Su utilización en rectificadores ha disminuido por el mayor empleo del silicio y el germanio en esta aplicación. El selenio se emplea también en exposímetros fotográficos y como aditivo metalúrgico que mejora la capacidad de ciertos aceros para ser maquinados.
El selenio arde en el aire con una flama azul para dar dióxido de selenio, SeO2. El elemento también reacciona directamente con diversos metales y no metales, entre ellos el hidrógeno y los halógenos. Los ácidos no oxidantes, no reaccionan con el selenio; pero el ácido nítrico, el ácido sulfúrico concentrado y los hidróxidos alcalinos fuertes lo disuelven.
El único compuesto importante del selenio con hidrógeno es el seleniuro de hidrógeno, H2Se, gas venenoso incoloro e inflamable con un olor desagradable, gran toxicidad y estabilidad térmica menor que la del sulfuro de hidrógeno. Disuelto en agua, el seleniuro de hidrógeno puede precipitar muchos iones de metales pesados como seleniuros muy poco solubles. Los compuestos orgánicos con enlaces C-Se son muchos e incluyen desde simples selenoles, RSeH; ácido selenénico, RseOH; haluros organil selénicos, RSeX; seleniuros diorganílicos y diseleniuros, R2Se y R2Se2, hasta moléculas que exhiben actividad biológica, como los selenoaminoácidos y los selenopéptidos.
CARACTERISTICAS
El selenio se puede encontrar en varias formas alotrópicas. El selenio amorfo existe en tres formas, la vítrea, negra, obtenida al enfriar rápidamente el selenio líquido, funde a 180 °C y tiene una densidad de 4,28 g/cm3; la roja, coloidal, se obtiene en reacciones de reducción; el selenio gris cristalino de estructura hexagonal, la forma más común, funde a 220,5 °C y tiene una densidad de 4,81 g/cm3; y la forma roja, de estructura monoclínica, funde a 221 °C y tiene una densidad de 4,39 g/cm3.
Es insoluble en agua y alcohol, ligeramente soluble en disulfuro de carbono y soluble en éter.
Presenta el efecto fotoeléctrico, convirtiendo la luz en electricidad, y, además, su conductividad eléctrica aumenta al exponerlo a la luz. Por debajo de su punto de fusión es un material semiconductor tipo p, y se encuentra en su forma natural.
El selenio fue descubierto en el año 1817, cuando el gran químico sueco Jöns Jacob von Berzelius (de quien ya hemos hablado cuando vimos las características del silicio y a quien también se le acredita el descubrimiento del torio y cesio), se encontraba de visita en una fábrica de ácido sulfúrico. Allí pudo ver una sustancia líquida de color parduzco y de un aroma fétido que le hizo encontrar ciertas similitudes entre el selenio y el metal telurio. El nombre de este elemento está muy relacionado con la Luna y proviene del término griego "σελήνιον", selene, que refiere al resplandor de la Luna.
Se trata de un elemento de características únicas, siendo éste uno de los elementos más raros de la tabla periódica. Junto a elementos como el hidrógeno, el nitrógeno y el fósforo, se clasifica como un no metal. Si bien existen diversas formas alotrópicas de selenio, sólo tres de ellas se conocen en profundidad: el selenio amorfo, de color rojo; en forma de polvo, de color negro; y en forma cristalina (la forma maś estable del selenio), de un característico color gris metálico.
El selenio se encuentra en estado natural y elemental en muchas plantas y vegetales, siendo un elemento nutritivo esencial. No obstante, formas del selenio, tales como el seleniuro de hidrógeno (H2Se) y otros compuestos de este elemento son altamente tóxicos. Posee 21 isótopos que se conozcan y sólo 6 de éstos son estables.
Es insoluble en agua y alcohol, ligeramente soluble en disulfuro de carbono y soluble en éter.
Presenta el efecto fotoeléctrico, convirtiendo la luz en electricidad, y, además, su conductividad eléctrica aumenta al exponerlo a la luz. Por debajo de su punto de fusión es un material semiconductor tipo p, y se encuentra en su forma natural.
El selenio fue descubierto en el año 1817, cuando el gran químico sueco Jöns Jacob von Berzelius (de quien ya hemos hablado cuando vimos las características del silicio y a quien también se le acredita el descubrimiento del torio y cesio), se encontraba de visita en una fábrica de ácido sulfúrico. Allí pudo ver una sustancia líquida de color parduzco y de un aroma fétido que le hizo encontrar ciertas similitudes entre el selenio y el metal telurio. El nombre de este elemento está muy relacionado con la Luna y proviene del término griego "σελήνιον", selene, que refiere al resplandor de la Luna.
Se trata de un elemento de características únicas, siendo éste uno de los elementos más raros de la tabla periódica. Junto a elementos como el hidrógeno, el nitrógeno y el fósforo, se clasifica como un no metal. Si bien existen diversas formas alotrópicas de selenio, sólo tres de ellas se conocen en profundidad: el selenio amorfo, de color rojo; en forma de polvo, de color negro; y en forma cristalina (la forma maś estable del selenio), de un característico color gris metálico.
El selenio se encuentra en estado natural y elemental en muchas plantas y vegetales, siendo un elemento nutritivo esencial. No obstante, formas del selenio, tales como el seleniuro de hidrógeno (H2Se) y otros compuestos de este elemento son altamente tóxicos. Posee 21 isótopos que se conozcan y sólo 6 de éstos son estables.
USOS
El selenio gris conduce la electricidad, aunque su conductividad varía con la intensidad luminosa: es mejor conductor en la luz que en la oscuridad. Se usa por lo tanto en muchos dispositivos fotoeléctricos.En forma de selenio rojo o como seleniuro de sodio el elemento se usa para dar un color rojo escarlata al vidrio, barnices y esmaltes.
Se usa también en gran medida como un decolorante del vidrio porque neutraliza el matiz verdoso producido por los compuestos ferrosos.
Pequeñas cantidades de selenio se agregan al caucho vulcanizado para aumentar su resistencia al desgaste.
El seleniato de sodio es un insecticida usado para combatir insectos en los cultivos de plantas ornamentales, particularmente crisantemos y claveles; los insecticidas se esparcen alrededor de las raíces y es distribuido por la planta.
El sulfuro de selenio se usa en el tratamiento de la caspa, el acné, dermatitis seborreica y otras enfermedades de piel.
El selenio también se usa en fotocopiadoras, semiconductores, aleaciones y células solares.
Se usa también en algunas técnicas fotográficas especiales.
TELURIO
¿QUE ES?
Elemento químico de símbolo Te, número atómico 52 y peso atómico 127.60. Existen ocho isótopos estables del telurio. El telurio constituye aproximadamente el 10-9 % de la roca ígnea que hay en la Tierra. Se encuentra como elemento libre, asociado algunas veces con selenio, y también existe como telururo de silvanita (teluro gráfico), nagiagita (telurio negro), hessita, tetradimita, altaita, coloradoita y otros telururos de plata y oro, así como el óxido, telurio ocre.
Existen dos modificaciones alotrópicas importantes del telurio elemental: la forma cristalina y la amorfa. La forma cristalina tiene un color blanco plateado y apariencia metálica. Esta forma se funde a 449.5ºC (841.6ºF). Tiene una densidad relativa de 6.24 y una dureza de 2.5 en la escala de Mohs. La forma amorfa (castaña) tiene una densidad relativa de 6.015. El telurio se quema en aire despidiendo una flama azul y forma dióxido de telurio, TeO2. Reacciona con los halógenos, pero no con azufre o selenio, y forma, entre otros productos, tanto el anión telururo dinegativo (Te2-), que se asemeja al selenuro, como el catión tetrapositivo (Te4+), que se parece al platino (IV).
El telurio se utilizó inicialmente como aditivo del acero para incrementar su ductilidad, como abrillantador en electroplateados, como aditivo en catalizadores para la desintegración catalítica del petróleo, como material colorante de vidrios y como aditivo del plomo para incrementar su fuerza y resistencia a la corrosión.
Existen dos modificaciones alotrópicas importantes del telurio elemental: la forma cristalina y la amorfa. La forma cristalina tiene un color blanco plateado y apariencia metálica. Esta forma se funde a 449.5ºC (841.6ºF). Tiene una densidad relativa de 6.24 y una dureza de 2.5 en la escala de Mohs. La forma amorfa (castaña) tiene una densidad relativa de 6.015. El telurio se quema en aire despidiendo una flama azul y forma dióxido de telurio, TeO2. Reacciona con los halógenos, pero no con azufre o selenio, y forma, entre otros productos, tanto el anión telururo dinegativo (Te2-), que se asemeja al selenuro, como el catión tetrapositivo (Te4+), que se parece al platino (IV).
El telurio se utilizó inicialmente como aditivo del acero para incrementar su ductilidad, como abrillantador en electroplateados, como aditivo en catalizadores para la desintegración catalítica del petróleo, como material colorante de vidrios y como aditivo del plomo para incrementar su fuerza y resistencia a la corrosión.
CARACTERISTICAS
El nombre del telurio proviene del término en latín tellus, que era el nombre romano del dios de la Tierra. Fue descubierto por el geólogo y químico húngaro Franz-Joseph Müller von Reichenstein en el año 1782, mientras analizaba una veta azulina de Transilvania que había encontrado en minas minerales de Hungría.
Si bien al principio creyó que se trataba de antimonio, no tardó en notar que se trataba de un nuevo elemento, siéndole acreditado el descubrimiento del telurio. Por otra parte, en el año 1798, el gran químico alemán Martin Heinrich Klaproth (de quien ya hemos hablado en varias ocasiones puesto que también estuvo involucrado en el descubrimiento del uranio, el circonio y el titanio) le dió el nombre de telurio.
El telurio es un metaloide de un pálido color plateado y blancuzco que en estado puro tiene una increíble brillantez metálica. En la tabla periódica lo podemos encontrar en el grupo número 16, en el período 5, siendo uno de los metaloides más conocidos que existen. Cristalizado, el telurio se puede pulverizar con facilidad, mientras que, si se funde, se puede aplicar como corrosivo para el hierro, el cobre y el acero inoxidable.
Se conocen 30 isótopos de telurio, 8 de ellos sólo en estado natural. Sus compuestos son tóxicos.En la naturaleza, es bastante extraño que el telurio se produzca. Generalmente se produce mediante refinación electrolítica.
Si bien al principio creyó que se trataba de antimonio, no tardó en notar que se trataba de un nuevo elemento, siéndole acreditado el descubrimiento del telurio. Por otra parte, en el año 1798, el gran químico alemán Martin Heinrich Klaproth (de quien ya hemos hablado en varias ocasiones puesto que también estuvo involucrado en el descubrimiento del uranio, el circonio y el titanio) le dió el nombre de telurio.
El telurio es un metaloide de un pálido color plateado y blancuzco que en estado puro tiene una increíble brillantez metálica. En la tabla periódica lo podemos encontrar en el grupo número 16, en el período 5, siendo uno de los metaloides más conocidos que existen. Cristalizado, el telurio se puede pulverizar con facilidad, mientras que, si se funde, se puede aplicar como corrosivo para el hierro, el cobre y el acero inoxidable.
Se conocen 30 isótopos de telurio, 8 de ellos sólo en estado natural. Sus compuestos son tóxicos.En la naturaleza, es bastante extraño que el telurio se produzca. Generalmente se produce mediante refinación electrolítica.
USOS
Se usa en algunas aleaciones de cobre y plomo para aumentar la resistencia a la tensión, en la fabricación de rectificadores y dispositivos termoeléctricos y en la investigación de semiconductores.
Junto con otras sustancias orgánicas, es empleado como agente vulcanizador en el procesamiento del caucho sintético y natural.
Se usa también para dar color azul al vidrio.
El teluro coloidal se usa como insecticida, germicida y fungicida.
Junto con otras sustancias orgánicas, es empleado como agente vulcanizador en el procesamiento del caucho sintético y natural.
Se usa también para dar color azul al vidrio.
El teluro coloidal se usa como insecticida, germicida y fungicida.
POLONIO
¿QUE ES?
Elemento químico, símbolo Po, de número atómico 84. Marie Curie descubrió el radioisótopo 210Po en la pecblenda (uraninita), isótopo que es el penúltimo miembro de las series del decaimiento del radio. Todos los isótopos del polonio son radiactivos y de vida media corta, excepto los tres emisores alfa, producidos artificialmente. 208Po (2.9 años) y 209Po (100 años), y el natural, 210Po (138.4 días).
El polonio (210Po) se utiliza principalmente en la producción de fuentes de neutrones. Puede usarse también en eliminadores de estática, y cuando está incorporado en la aleación de los electrodos de las bujías, se dice que favorece las propiedades enfriantes en los motores de combustión interna.
La mayor parte de la química del polonio se ha determinado usando 210Po, 1 curie del cual pesa 222.2 microgramos; trabajar con cantidades considerables es peligroso y se requieren técnicas especiales. El polonio es más metálico que su homólogo inferior, el telurio. Como metal, es químicamente parecido al telurio y forma los compuestos rojo brillante SPoO3 y SePoO3. El metal es blando y sus propiedades físicas recuerdan las del talio, plomo y bismuto. Las valencias 2 y 4 están bien establecidas; hay algunas evidencias de hexavalencia. El polonio está colocado entre la plata y el telurio en la serie electroquímica.
Se conocen dos formas del dióxido: a baja temperatura, amarillo, cúbico centrado en las caras (tipo UO2), y a alta temperatura, rojo, tetragonal. Los halogenuros son covalentes, compuestos volátiles, y recuerdan a los análogos del telurio.
CARACTERISTICAS
Esta sustancia se disuelve con mucha facilidad en ácidos, pero es sólo ligeramente soluble en alcalinos. Está químicamente relacionado con el teluro y el bismuto. El polonio es un metal volátil, reducible al 50% tras 45 horas al aire a una temperatura de 54,8 °C (328 K). Ninguno de los 50 isotopos [numero estimado] de polonio es estable. Es extremadamente tóxico y altamente radiactivo. Se ha encontrado polonio en minerales de uranio, humo de tabaco y como contaminante. Todos los elementos a partir del polonio son significativamente radiactivos. Se encuentra en el grupo 16 y su número atómico es 84.
El polonio recibió su nombre en honor a la tierra natal de quien descubrió dicho elemento, obviamente, nada más ni nada menos que la señora Maria Salomea Skłodowska-Curie, mejor conocida como Marie Curie, una de las científicas más importantes de la historia. Curie descubrió el polonio en 1898, siendo conocido también como Radium F.
Bien conocida es la historia de Curie con el polonio, este es un elemento sumamente extraño, metaloide y altamente radiactivo, el cual de hecho, provocó la lenta muerte de Curie. En términos químicos, el polonio es similar a elementos como el telurio (Te) y el bismuto (Bi), aunque presenta varias características que lo hacen muy extravagante. Existen 25 isótopos de polonio conocidos y estos tienen masas atómicas que van de 194 u a 218 u.
Este metaloide tiene un bajo punto de fusión, es volátil, se disuelve en ácidos fluidos y presenta un característico color plateado brillante. En estado natural, el polonio es muy difícil de encontrar, pero no imposible. Comúnmente, el polonio se consigue mediante el bombardeo natural del bismuto con neutrones, de donde se extrae la matriz del polonio.
USOS
Este isótopo es el último componente de las series del decaimiento del radio. Por tal razón, todos sus isótopos son radiactivos y poseen una corta vida. Sin embargo, existen tres isótopos que son emisores alfa y dos de ellos se producen en forma artificial, cuya vida es en cada caso 2,9 años para el polonio-208 y 100 años para el polonio-209. La forma natural que es el polonio 210 posee un promedio de vida de unos 138,4 días.
La composición química del polonio, es similar a la del bismuto y a la del telurio, pero tiene algunas características que lo hacen diferente de los anteriores.
Este elemento químico es poco utilizado en actividades humanas motivado a su gran radiactividad. Su uso más frecuente es para la eliminación de la electricidad estática en textiles, en los cepillos para la limpieza del polvo en las películas fotográficas y en los satélites espaciales como fuente de calor de ligero peso, ya que en pocas cantidades, es capaz de generar gran cantidad de energía y de calor.
GRUPO 7 DE LA TABLA PERIÓDICA
MANGANESO
¿QUE ES?
El manganeso es un elemento químico de número atómico 25 situado en el grupo 7 de la tabla periódica de los elementos y se simboliza como Mn.12 Se encuentra como elemento libre en la naturaleza, a menudo en combinación con el hierro y en muchos minerales. Como elemento libre, el manganeso es un metal con aleación de metales industriales con importantes usos, sobre todo en los aceros inoxidables.
El fosfatado de manganeso se utiliza como tratamiento para la prevención de la oxidación y corrosión del acero. Dependiendo de su estado de oxidación, los iones de manganeso tienen colores diferentes y se utilizan industrialmente como pigmentos. Los permanganatos alcalinos y de metales alcalinotérreos son oxidantes poderosos. El dióxido de manganeso se utiliza como cátodo.
Los iones de manganeso funcionan como cofactores de una serie de enzimas en los organismos superiores, donde son esenciales en la desintoxicación de los radicales libres de superóxido. El elemento es un mineral traza esencial para todos los seres vivos conocidos. En cantidades mayores, y al parecer con una actividad mucho mayor por la inhalación, el manganeso puede causar un síndrome de intoxicación en los mamíferos, con daños neurológicos que a veces son irreversibles.
CARACTERISTICAS
El manganeso es un metal de transición blanco grisáceo, parecido al hierro. Es un metal duro y muy frágil, refractario y fácilmente oxidable. El manganeso metal puede ser ferromagnético, pero sólo después de sufrir un tratamiento especial.
Sus estados de oxidación más comunes son 2+, 3+, 4+, 6+ y +7, aunque se han encontrado compuestos con todos los números de oxidación desde 1+ a 7+; los compuestos en los que el manganeso presenta estado de oxidación 7+ son agentes oxidantes muy enérgicos. Dentro de los sistemas biológicos, el catión Mn2+ compite frecuentemente con el Mg2+. Se emplea sobre todo aleado con hierro en aceros y en otras aleaciones.
USOS
- El traquetreo de los motores se reduce mediante el uso de un compuesto de manganeso que se añade a la gasolina sin plomo. Esto aumenta el octanaje del combustible.
- El manganeso se utiliza en las baterías desechables estándar.
- El manganeso es esencial para producir el acero y el hierro. El manganeso es un componente esencial para la fabricación de acero inoxidable de bajo costo.
- El manganeso es aleado con aluminio para producir una aleación que es más resistente a la corrosión.
- La mayoría de las latas de aluminio para bebidas contienen entre el 0,8 % y el 1,5 % de manganeso.
- En química, el óxido de manganeso se utiliza para oxidar el alcohol bencílico.
- La contaminación de hierro puede hacer que el vidrio se tinte de color verde. Ya desde tiempos antiguos se añade un compuesto de manganeso al vidrio para contrarrestar este efecto.
- El dioxígeno y el dicloro se procesan utilizando dióxido de manganeso. Este mismo compuesto es también un pigmento marrón que se puede utilizar para fabricar pinturas.
- El vidrio y la cerámica se pueden colorear mediante diversos compuestos de manganeso.
- En algunas partes del mundo, el manganeso se utiliza para fabricar monedas.
TECNECIO
¿QUE ES?
El tecnecio es el más ligero de los elementos químicos que no cuentan con isótopos estables y el primer elemento sintético que se encuentra en la tabla periódica. Su número atómico es el 43 y su símbolo es Tc. Las propiedades químicas de este metal de transición cristalino de color gris plateado son intermedias a las del renio y las del manganeso. Su isómero nuclear 99mTc, de muy corta vida y emisor de rayos gamma, se usa en medicina nuclear para efectuar una amplia variedad de pruebas diagnósticas. El 99Tc se usa como fuente de partículas beta libre de la emisión de rayos gamma. El anión pertecnetato (TcO4-) se emplea como inhibidor de corrosión anódica para aceros.
Antes de que fuera descubierto, muchas de las propiedades del elemento fueron predichas por Dmitri Mendeleev. Mendeleev reservó un espacio en su tabla periódica para un hipotético elemento que llamó eka - manganeso. En 1937, el isótopo 97Tc se convirtió en el primer elemento producido de forma predominantemente artificial, de ahí su nombre (del griego τεχνητός, que significa "artificial"). La mayoría del tecnecio producido en la Tierra se obtiene como subproducto de la fisión del 235U en los reactores nucleares y se extrae de las varillas de combustible nuclear. Ningún isótopo del tecnecio posee un periodo de semidesintegración mayor de 4,2 millones de años (el caso concreto del 98Tc), así que su detección en gigantes rojas en 1952 ayudó a reforzar la teoría de que en las estrellas pueden generarse elementos pesados. En la Tierra, el tecnecio se encuentra en trazas detectables como producto de la fisión espontánea en minerales de uranio por acción de la captura de neutrones en menas de molibdeno.
CARACTERISTICAS
El tecnecio es un metal radiactivo de gris plateado con una apariencia similar al metal platino. Sin embargo, cuando se obtiene generalmente tiene la forma de polvo grisáceo. Su posición en la tabla periódica está entre el molibdeno y el rutenio, y como predicen las leyes periódicas, sus propiedades son intermedias a estos dos metales. El tecnecio, al igual que el prometio, es excepcional entre los elementos ligeros, ya que no posee ningún isótopo estable (y, sin embargo, está rodeado por elementos que sí los tienen).
Dada su inestabilidad, el tecnecio es extremadamente escaso en la Tierra. No desempeña ningún papel biológico y, en condiciones normales, no se encuentra en el cuerpo humano.
La forma metálica del tecnecio se desluce rápidamente en presencia de aire húmedo. Sus óxidos son el TcO2 y el Tc2O7. Bajo condiciones oxidantes, el tecnecio (VII) existe en forma de anión pertecnetato, TcO4-.Los estados de oxidación más habituales del tecnecio son 0, +2, +4, +5, +6 y +7. Cuando el tecnecio está pulverizado, arde en presencia de oxígeno. Se disuelve en agua regia, ácido nítrico y en ácido sulfúrico concentrado, pero no en ácido clorhídrico. Posee líneas espectrales características a las siguientes longitudes de onda: 363 nm, 403 nm, 410 nm, 426 nm, 430 nm y 485 nm.
La forma metálica es ligeramente paramagnética, es decir, sus dipolos magnéticos se alinean con los campos magnéticos externos, a pesar de que el tecnecio normalmente no es magnético. La estructura cristalina del metal presenta un empaquetamiento hexagonal compacto. Un cristal aislado de puro tecnecio metálico se convierte en un superconductor de tipo II a una temperatura de 7,46 K; la irregularidad de los cristales y las trazas de impurezas elevan este valor a 11,2 K para el caso de un tecnecio pulverizado de una pureza del 99,9%. Por debajo de esta temperatura, el tecnecio posee una muy alta profundidad de penetración magnética, la mayor de todos los elementos después del niobio.
USOS
Como el renio y el paladio, el tecnecio puede usarse como catalizador. Para algunas reacciones, por ejemplo la deshidrogenación del alcohol isopropílico, supone un catalizador mucho más efectivo que el renio o el paladio. Por supuesto, su radiactividad es el mayor problema a la hora de encontrar aplicaciones seguras.
Bajo ciertas circunstancias, una pequeña concentración (5·10-5 mol·l-1) del anión pertecnetato en agua puede proteger hierros y aceros al carbono de la corrosión. Por esta razón, el pertecnetato puede emplearse como inhibidor de la corrosión anódica para el acero, pero la radiactividad del tecnecio presenta ciertos problemas a la hora de usarlo para aplicaciones estrictamente químicas como ésta. Aunque (por ejemplo) el anión CrO42- puede también inhibir la corrosión, se requieren concentraciones hasta diez veces mayores. En un experimento, una muestra se mantuvo en una disolución acuosa de pertecnetato durante 20 años y no sufrió corrosión alguna. El mecanismo mediante el cual el anión pertecnetato previene la corrosión no se conoce muy bien, pero parece implicar la formación de una delgada capa superficial. Una teoría mantiene que el pertecnetato reacciona con la superficie del acero formando una capa de dióxido de tecnecio que previene una posterior corrosión; el mismo efecto explica como el hierro en polvo puede utilizarse para eliminar el pertecnetato del agua (el carbón activado también puede usarse para ese fin). El efecto desaparece rápidamente si la concentración de pertecnetato cae por debajo de un mínimo o si se añade una alta concentración de otros iones.
Evidentemente, la naturaleza radiactiva del tecnecio (3 MBq por litro para la concentración requerida) hace este tipo de protección impracticable en casi todas las situaciones. Sin embargo, la protección ante la corrosión usando aniones pertecnetato se ha sugerido (aunque nunca aplicado) para su uso en reactores de agua en ebullición.
En los últimos años de la década de 1970, se efectuó con éxito la electrodeposición del tecnecio sobre varios sustratos, llevada a cabo por Lichtenberger en la Universidad de Virginia como parte de un estudio de investigación sobre el uso de emisiones beta débiles para evitar la degradación biológica de instrumentación marina. Estos estudios fueron frustrados por la baja estabilidad en el agua marina.
RENIO
¿QUE ES?
El renio —de Rhenus, nombre latino del Rin— es un elemento químico, de número atómico 75, que se encuentra en el grupo 7 de la tabla periódica de los elementos y cuyo símbolo es Re, descubierto en 1925 por tres científicos alemanes. Es un metal de transición de color blanco-plata, sólido, refractario y resistente a la corrosión, muy utilizado en joyería y como catalizador. Sus propiedades químicas son muy parecidas a las del manganeso, es muy escaso en la corteza terrestre y se obtiene principalmente a partir de minerales de molibdeno.
Existen 35 isótopos y 26 radioisótopos de este elemento, de los cuales los más estables son el 185Re y el 187Re. Los principales yacimientos de renio se encuentran en América y Asia, destacando los de Chile y Kazajistán.
CARACTERISTICAS
En su forma natural el renio es un elemento sólido, de color blanco plateado y grisáceo, y pertenece a la serie química de los metales de transición. Es uno de los metales con punto de fusión más elevado, solo superado por el wolframio y el carbono. Tiene estados de oxidación -1, 0, +1, +2, +3, +4, +5, +6 y +7.1 Es capaz de formar aniones complejos, tales como el pentacloruro de renio, que son capaces de crear sales diferentes debido al efecto de oxidación que produce este elemento cuando recibe el contacto del aire.
El renio es uno de los metales más densos que existen, ya que su densidad de 21 020 kg/m3 solo es superada por el iridio, el osmio y el platino. Es un elemento escaso en la corteza terrestre (solo 0,001 ppm), mientras que en el aire es estable a temperaturas superiores a los 400°C, punto a partir del cual comienza a arder y produce heptaóxidos. También hay que destacar que hay pocos picómetros (pm) de diferencia entre los radios medio (135 pm), atómico (137 pm) y covalente (159 pm).
USOS
El renio, al ser un elemento metálico refractario y resistente a la corrosión, es usado principalmente en joyería, en la construcción de filamentos para espectrómetros de masas y como catalizador de reacciones de hidrogenación y deshidrogenación en la industria química. En menor escala se utiliza en aleaciones de wolframio y molibdeno, como conductor eléctrico, en la fabricación de flashes fotográficos y para la construcción de los plumines de las estilográficas. Recientemente científicos chilenos han desarrollado un compuesto derivado del renio que ataca a las células cancerosas, pasando a ser utilizado en medicina para el diagnóstico y tratamiento del cáncer.
BOHRIO
¿QUE ES?
El bohrio es un elemento químico de la tabla periódica cuyo símbolo es Bh y su número atómico es 107. Su nombre le fue dado en honor al científico danés Niels Bohr.
Elemento químico que se espera que tenga propiedades químicas semejantes a las del elemento renio. Fue sintetizado e identificado sin ambigüedad en 1981 por un equipo de Darmstadt, Alemania, equipo dirigido por P. Armbruster y G. Müzenberg. La reacción usada para producir el elemento fue propuesta y aplicada en 1976 por un grupo de Dubna (cerca de Moscú), que estaba bajo la guía de Yuri Oganesián. Un blanco de 209Bi fue bombardeado por un haz de proyectiles de 54Cr.
La mejor técnica par identificar un nuevo isótopo es su correlación genética con isótopos conocidos a través de una cadena de desintegración radiactiva. En general, estas cadenas de decaimiento se interrumpen por fisión espontánea. Con el fin de aplicar el análisis de cadena de decaimiento deberían producirse aquellos isótopos que son más estables frente a la fisión espontánea, es decir, isótopos con números impares de protones y neutrones. Para hacer que estas pérdidas por fisión se mantengan pequeñas, debe producirse un núcleo con la mínima energía de excitación posible. En este aspecto, son ventajosas las reacciones en las que se utilizan compañeros de colisión relativamente simétricos y núcleos estrechamente enlazados de capa cerrada como el 209Bi y el 208Pb como blancos, y el 48Ca y el 50Ti como proyectiles. En el experimento de Darmstadt se encontraron seis cadenas de decaimiento. Todos los decaimientos pueden atribuirse al 262Bh, un núcleo impar producido en una reacción de un neutrón. El isótopo 262Bh decae por decaimiento de partícula alfa, con una vida media de unos 5ms. Ciertos experimentos de Dubna, llevados a cabo en 1983, establecieron la producción de 262Bh en la reacción 209Bi + 54Cr.
CARACTERISTICAS
Es un elemento artificial, que no existe en la naturaleza, producido sintéticamente en el laboratorio. Se trata de otro elemento de escasa producción y también se presume que se trata de un metal sólido. Su estudio es particularmente dificultoso, pero el equipo alemán al que se le atribuye su descubrimiento logró distinguir 6 núcleos de bohrio. Actualmente se conocen 10 isótopos de bohrio. El más estable es el 270Bh, el cual tiene una vida media de aproximadamente 1 minuto.
USOS
Con este elemento sucede algo muy peculiar, de todos los que hemos visto hasta hoy en la sección, éste es el primero que no tiene utilidad alguna. El bohrio no se usa para nada y actualmente, no se desarrollan estudios científicos sobre el elemento.