NOMENCLATURA DE ALCOHOLES Y FENOLES
INTRODUCCIÓN
En este blog encontraremos información y ejercicios sobre nomenclatura de alcoholes y fenoles, en la practica que realizamos en clase se elige el nombre según la nomenclatura de los ejercicios .
OBJETIVOS
- Reconocer el concepto de alcoholes y fenoles
- Distinguir los alcoholes y los fenoles
- Señalar correctamente la nomenclatura de los alcoholes y los fenoles
- Identifica las reacciones de obtención de alcoholes y fenoles
ALCOHOLES
USOS
- En Medicina, como Agente Antiséptico y Desinfectante
- Alcohol medicinal. Antiséptico y desinfectante
- En la industria química, en preparación de Éter Etílico
- En la industria química, en preparación de Acetaldehído
- En la industria química, en preparación de Ésteres Etílicos
- Como combustible alterno, proveniente de la fermentación de la caña de azúcar
- Como combustible adicional a la gasolina
- Alcohol etílico como combustible total o parcial
- En la industria farmacéutica, en preparación de Tintura de iodo
- En la industria farmacéutica, en preparación de yodoformo
- En la industria farmacéutica, en preparación de Cloroformo
- En la industria de la Perfumería, en producción de Extractos
- En la industria de la Perfumería, en producción de Lociones
- En la industria de la Perfumería, en producción de Perfumes
- En la industria alimenticia, para regular el nivel alcohólico en bebidas
- Alcohol, presente en bebidas
- Como reactivo químico, actuando como deshidratante
EJERCICIOS NOMENCLATURA DE ALCOHOLES
ALCOHOLES II
FORMULA GENERAL
Ar— (OH)n
GRUPO FUNCIONAL
--- O --- H
¿ QUE SON?
Los fenoles son derivados de los alcoholes, son muy solubles en agua y en la mayoría de los disolventes orgánicos. Son altamente tóxicos para el ser humano y su contacto puede provocar la muerte.
PROPIEDADES
Su Fórmula química es C6H5OH, y tiene un Punto de fusión de 43 °C y un Punto de ebullición de 182 °C. El fenol no es un alcohol, debido a que el grupo funcional de los alcoholes es R-OH,y en el caso del fenol es Ph-OH. El fenol es conocido también como ácido fénico o ácido carbólico, cuya Ka es de 1,3 • 10-10. Se puede detectar el sabor y el olor del fenol a niveles más bajos que los asociados con efectos nocivos. El fenol se evapora más lentamente que el agua y una pequeña cantidad puede formar una solución con agua. El fenol se inflama fácilmente, es corrosivo y sus gases son explosivos en contacto con la llama. El producto comercial es un líquido. Tiene un olor repugnantemente dulce y alquitranado
PROPIEDADES QUÍMICAS
Químicamente, el fenol, se caracteriza por la influencia mutua entre el grupo Hidroxilo u Oxidrilo (HO:) y el Anillo aromático. El grupo fenilo ó fenil negativo, es la causa de una leve acidez del grupo oxidrílico (pK en solución acuosa a 25 ºC es 1.3 x 10 -10). En fenol reacciona con las bases fuertes para formar sales llamadas Fenóxidos (alguna veces fenonatos ó fenolatos): C6H5-OH + NaOH H2O + C6H5-ONa Los fenatos de sodio y potasio, son rápidamente descompuestos por el bióxido de azufre; éste compuesto, también descompone al fenol. El Grupo hidroxilo puede ser fácilmente eterificado y eterificado. El acetato de fenilo CH3 = COO = C6H5, el fosfato de trifenilo (C6H5)3PO4 y el salicilato de fenilo (C6H5)2O son los éteres comerciales más conocidos del fenol. El fenol es rápidamente oxidado a una variedad de productos que incluye a los Bancenodioles (hidroquinona, resorcinol y pirocatecol), bencenotrioles y derivados del difenilo (difenoles ó bifenoles) HO-C6H4-OH, y óxido de difenilo (dibenzofurano) y productos de descomposición, dependiendo este del agente occidente y de las condiciones de operación. La reducción del fenol con zinc por destilación, da Benceno, y la hidrogenación del fenol, finalmente, es método para la obtención del Ciclohexanol. El gurpo hidroxilo de una alta reactividad al grupo fenilo. Los átomos del hidrógeno en las posiciones o- (orto) y p- (para), con respecto del grupo hidroxilo, son altamente reactivos (orienta las sustituciones hacia esas posiciones); o sea, los hidrógenos en 2- y 4- son los primeros en ser sustituidas para formar el monodreivados para formar el monoderivado inicial, después el 2- 4- ó el 2- 6- derivado, y finalmente el 2- 4- 6- triderivado, esto si las condiciones lo permite.
OBTENCIÓN
El fenol se presenta en la Naturaleza en la madera y en las agujas de pino, en la orina de los herbívoros (fenolsulfato) y en el alquitrán de hulla. Puede sintetizarse mediante la Oxidación parcial del Benceno. El fenol se obtiene a partir de la destilación del alquitrán de hulla. Según RÖMPP 1983, con 1 tonelada de hulla se obtiene aproximadamente 0,25 kg de fenol Actualmente, predomina la producción sintética por disociación del Hidroperóxido de cumeno, obteniéndose acetona como producto secundario
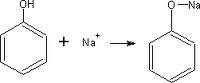
Formación de sales: El fenol al ser un ácido débil, reacciona con facilidad con una base fuerte como la del sodio, litio o potasio.
Esta reacción si bien las presentan los alcoholes alifáticos, es más débil en estos. En el caso del fenol se da con mayor tendencia.
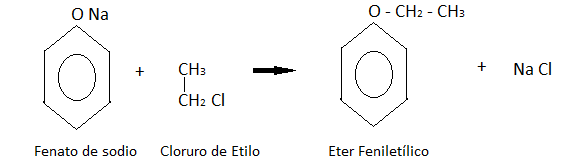
Formación de éteres: Los fenatos de sodio se tratan con halogenuros de alquilo. En este caso particular con cloruro de metilo, obteniendo el éter feniletílico como indica la reacción.
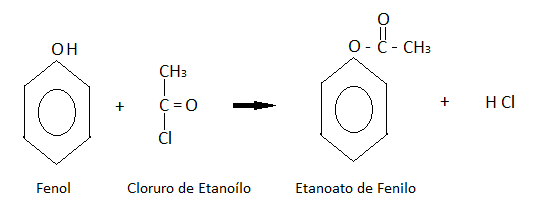
Formación de ésteres: El fenol reacciona con cloruros derivados de ácidos orgánicos formando ésteres.
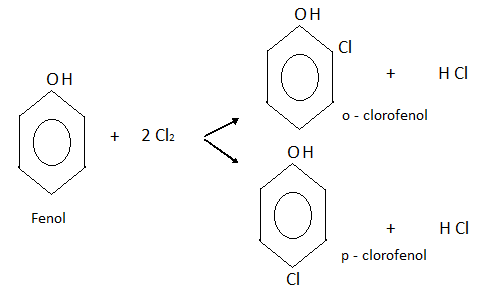
Entre las reacciones del anillo aromático, es decir, de sustitución, podemos nombrar las principales. Halogenación: Haciendo reaccionar al fenol con cloro, por ejemplo, se obtiene una mezcla de o-clorofenol y p-clorofenol.
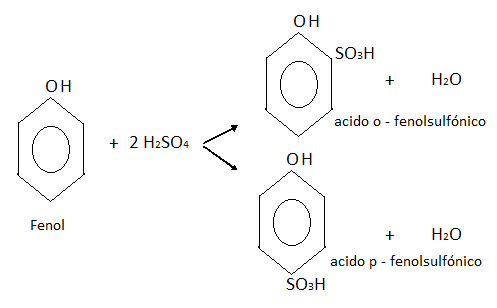
Sulfonación: El fenol se puede combinar con el ácido sulfúrico en caliente, dando una mezcla de dos isómeros de ácido o-fenol sulfónico y p-fenol sulfónico.
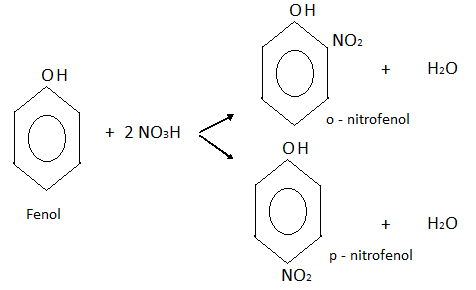
Nitración: En este caso también se obtiene una mezcla de dos isómeros, o-nitrofenol y p-nitrofenol.
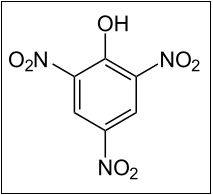
Si el ácido nítrico fuera más concentrado, obtendríamos el 2,4,6,-trinitrofenol también llamado ácido pícrico.
USOS
Se usa para la fabricación de resinas sintéticas, ácido pícrico (usado a su vez para explosivos), ácido salicílico (materia prima para las aspirinas), colorantes, etc. Se ha usado mucho tiempo como agente antiséptico.
EJERCICIOS NOMENCLATURA DE FENOLES
FENOLES


WEBGRAFIA
Nomenclatura
http://www.100ciaquimica.net/f
Marco teórico
https://quimicayalgomas.com/quimica-organica/alcoholes-aldehidos-cetonas/alcoholes-parte-4/
https://medium.com/@salmaG/qu%C3%ADmica-org%C3%A1nica-nomenclatura-de-alcoholes-y-fenoles-bffaf421e43f
Formula general
R-(OH)n
Grupo funcional
- O - H
¿QUE SON?
Son compuestos orgánicos que llevan en su molécula una o varias veces el grupo HIDROXILO (OH), unido a un átomo de carbono, que a su vez hace parte de una cadena hidrocarbonada, alifática y saturada.
LOS ALCOHOLES SE CLASIFICAN
Posición del grupo – OH: según el carbono que soporta el OH.
- Alcoholes primarios:
cuando el grupo OH esta unido a un carbón primario
- Alcohol secundario:
Si el OH esta unido a un carbono secundario:
- Alcohol terciario:
En el que el grupo OH se encuentra unido a un carbono terciario.
Numero de grupos – OH:
- monol
- diol
- triol
- tetraol
Según el tipo de cadena:
- alifaticos
- aliciclicos
- aromatico
Según que el hidrocarburo sea saturado o insaturado:
- alcohol insaturado
- fenol
NOMENCLATURA
1. Se nombra numerando los carbonos de la cadena, comenzando por el extremo más próximo al grupo hidroxilo.
2. Luego las ramificaciones se nombran en orden alfabético.
3. Añadiendo terminación “OL” al nombre del alcano correspondiente.
PROPIEDADES FÍSICAS
· La solubilidad se explica entre el alcohol y el agua.
· A medida que aumenta el numero de carbonos disminuye la solubilidad
· A medida que aumenta el número de OH aumenta la solubilidad
· A mayor peso molecular mayor solubilidad
· Al aumentar el peso molecular, aumentan los puntos de ebullición.
· Son muy polares y forman puentes de hidrógeno al aumentar el grupo OH.
PROPIEDADES QUÍMICAS
- Transformaciones sobre el grupo funcional, las cuales pueden ser de dos tipos que implican la ruptura de C – O y la que implica la ruptura del enlace O – H.
1. Reacción con metales alcalinos
ALCÓXIDO METÁLICO: los alcoxidos son bases muy fuertes que por tratamiento con agua dan nuevamente el alcohol original e iones hidróxido.
R – OH + M+ R – O – M + ½ H2
ESTERIFICACION: Cuando un alcohol reacciona con un ácido generalmente se forma agua y un ester.
R- O - H + OH – C – R R - O - C – R’ + H2O
DESHIDRATACION: implica la ruptura del enlace C – O y de un enlace C – H vecino para formar el enlace doble C = C, con producción de una molécula de agua.
H – C – C H2O = CH2 + H2O + H+
OXIDACIÓN: son la base para la producción de compuestos carbonilicos, la reacción opuesta (reducción) produce alcoholes a partir de compuestos carbonilicos.
USOS
- En Medicina, como Agente Antiséptico y Desinfectante
- Alcohol medicinal. Antiséptico y desinfectante
- En la industria química, en preparación de Éter Etílico
- En la industria química, en preparación de Acetaldehído
- En la industria química, en preparación de Ésteres Etílicos
- Como combustible alterno, proveniente de la fermentación de la caña de azúcar
- Como combustible adicional a la gasolina
- Alcohol etílico como combustible total o parcial
- En la industria farmacéutica, en preparación de Tintura de iodo
- En la industria farmacéutica, en preparación de yodoformo
- En la industria farmacéutica, en preparación de Cloroformo
- En la industria de la Perfumería, en producción de Extractos
- En la industria de la Perfumería, en producción de Lociones
- En la industria de la Perfumería, en producción de Perfumes
- En la industria alimenticia, para regular el nivel alcohólico en bebidas
- Alcohol, presente en bebidas
- Como reactivo químico, actuando como deshidratante
EJERCICIOS NOMENCLATURA DE ALCOHOLES
ALCOHOLES II
FENOLES
FORMULA GENERAL
Ar— (OH)n
GRUPO FUNCIONAL
--- O --- H
¿ QUE SON?
Los fenoles son derivados de los alcoholes, son muy solubles en agua y en la mayoría de los disolventes orgánicos. Son altamente tóxicos para el ser humano y su contacto puede provocar la muerte.
PROPIEDADES
Su Fórmula química es C6H5OH, y tiene un Punto de fusión de 43 °C y un Punto de ebullición de 182 °C. El fenol no es un alcohol, debido a que el grupo funcional de los alcoholes es R-OH,y en el caso del fenol es Ph-OH. El fenol es conocido también como ácido fénico o ácido carbólico, cuya Ka es de 1,3 • 10-10. Se puede detectar el sabor y el olor del fenol a niveles más bajos que los asociados con efectos nocivos. El fenol se evapora más lentamente que el agua y una pequeña cantidad puede formar una solución con agua. El fenol se inflama fácilmente, es corrosivo y sus gases son explosivos en contacto con la llama. El producto comercial es un líquido. Tiene un olor repugnantemente dulce y alquitranado
PROPIEDADES QUÍMICAS
Químicamente, el fenol, se caracteriza por la influencia mutua entre el grupo Hidroxilo u Oxidrilo (HO:) y el Anillo aromático. El grupo fenilo ó fenil negativo, es la causa de una leve acidez del grupo oxidrílico (pK en solución acuosa a 25 ºC es 1.3 x 10 -10). En fenol reacciona con las bases fuertes para formar sales llamadas Fenóxidos (alguna veces fenonatos ó fenolatos): C6H5-OH + NaOH H2O + C6H5-ONa Los fenatos de sodio y potasio, son rápidamente descompuestos por el bióxido de azufre; éste compuesto, también descompone al fenol. El Grupo hidroxilo puede ser fácilmente eterificado y eterificado. El acetato de fenilo CH3 = COO = C6H5, el fosfato de trifenilo (C6H5)3PO4 y el salicilato de fenilo (C6H5)2O son los éteres comerciales más conocidos del fenol. El fenol es rápidamente oxidado a una variedad de productos que incluye a los Bancenodioles (hidroquinona, resorcinol y pirocatecol), bencenotrioles y derivados del difenilo (difenoles ó bifenoles) HO-C6H4-OH, y óxido de difenilo (dibenzofurano) y productos de descomposición, dependiendo este del agente occidente y de las condiciones de operación. La reducción del fenol con zinc por destilación, da Benceno, y la hidrogenación del fenol, finalmente, es método para la obtención del Ciclohexanol. El gurpo hidroxilo de una alta reactividad al grupo fenilo. Los átomos del hidrógeno en las posiciones o- (orto) y p- (para), con respecto del grupo hidroxilo, son altamente reactivos (orienta las sustituciones hacia esas posiciones); o sea, los hidrógenos en 2- y 4- son los primeros en ser sustituidas para formar el monodreivados para formar el monoderivado inicial, después el 2- 4- ó el 2- 6- derivado, y finalmente el 2- 4- 6- triderivado, esto si las condiciones lo permite.
OBTENCIÓN
El fenol se presenta en la Naturaleza en la madera y en las agujas de pino, en la orina de los herbívoros (fenolsulfato) y en el alquitrán de hulla. Puede sintetizarse mediante la Oxidación parcial del Benceno. El fenol se obtiene a partir de la destilación del alquitrán de hulla. Según RÖMPP 1983, con 1 tonelada de hulla se obtiene aproximadamente 0,25 kg de fenol Actualmente, predomina la producción sintética por disociación del Hidroperóxido de cumeno, obteniéndose acetona como producto secundario
Formación de sales: El fenol al ser un ácido débil, reacciona con facilidad con una base fuerte como la del sodio, litio o potasio.
Esta reacción si bien las presentan los alcoholes alifáticos, es más débil en estos. En el caso del fenol se da con mayor tendencia.
Formación de éteres: Los fenatos de sodio se tratan con halogenuros de alquilo. En este caso particular con cloruro de metilo, obteniendo el éter feniletílico como indica la reacción.
Formación de ésteres: El fenol reacciona con cloruros derivados de ácidos orgánicos formando ésteres.
Entre las reacciones del anillo aromático, es decir, de sustitución, podemos nombrar las principales. Halogenación: Haciendo reaccionar al fenol con cloro, por ejemplo, se obtiene una mezcla de o-clorofenol y p-clorofenol.
Sulfonación: El fenol se puede combinar con el ácido sulfúrico en caliente, dando una mezcla de dos isómeros de ácido o-fenol sulfónico y p-fenol sulfónico.
Nitración: En este caso también se obtiene una mezcla de dos isómeros, o-nitrofenol y p-nitrofenol.
Si el ácido nítrico fuera más concentrado, obtendríamos el 2,4,6,-trinitrofenol también llamado ácido pícrico.
USOS
Se usa para la fabricación de resinas sintéticas, ácido pícrico (usado a su vez para explosivos), ácido salicílico (materia prima para las aspirinas), colorantes, etc. Se ha usado mucho tiempo como agente antiséptico.
FENOLES
WEBGRAFIA
Nomenclatura
http://www.100ciaquimica.net/f
Marco teórico
https://quimicayalgomas.com/quimica-organica/alcoholes-aldehidos-cetonas/alcoholes-parte-4/
https://medium.com/@salmaG/qu%C3%ADmica-org%C3%A1nica-nomenclatura-de-alcoholes-y-fenoles-bffaf421e43f